EXAME DE LABORATÓRIO
* Você tem 5 horas para fazer as duas experiências, incluindo o tempo necessário para escrever os resultados na folha de respostas.
O número de algarismos significativos nas respostas numéricas devem estar de acordo com a estimativa dos erros experimentais.
PRATICA 1: DETERMINAÇÃO DA QUANTIDADE DE CARBONATO DE SÓDIO E BICARBONATO DE SÓDIO EM UMA MISTURA PROBLEMA.
Neste exercício prático você tratará de determinar a concentração de carbonato de sódio e bicarbonato de sódio (carbonato ácido de sódio ou, ainda, hidrogeno-carbonato de sódio) em uma solução que lhe será fornecida no laboratório. Para isto, usará um procedimento volumétrico, titulando a solução problema fornecida com ácido clorídrico de concentração exatamente conhecida.
O íon carbonato é uma base dibásica que pode ser determinado facilmente com um ácido forte. A titulação pode ser feita até hidrogeno-carbonato (bicarbonato) usando como indicador a fenolftaleína ou até ácido carbônico usando como indicador o alaranjado de metila. O ponto final mais adequado é obtido quando se faz a titulação até ácido carbônico, já que a precisão da análise é maior.
No quadro seguinte são indicados os intervalos de viragem de alguns indicadores com suas respectivas cores:
Indicador |
Intervalo de viragem (pH) |
Cor da forma ácida |
Cor da forma básica |
| Amarelo de alizarina | 10,1 - 12 |
Amarelo |
Laranja-vermelho |
| Timolftaleína | 8,3 - 10,5 |
Incolor |
Azul |
| Fenolftaleína | 8,0 - 9,8 |
Incolor |
Vermelho |
| Vermelho de fenol | 6,4 - 8,0 |
Amarelo |
Vermelho |
| Verde de bromocresol | 3,8 - 5,4 |
Amarelo |
Azul |
| Alaranjado de metila | 3,1 - 4,4 |
Vermelho |
Alaranjado |
Por outro lado, o cloreto de hidrogênio é uma espécie química gasosa que no laboratório se manipula em solução aquosa. Portanto, as concentrações das soluções obtidas por diluição do produto comercial serão simplesmente aproximadas e será necessário titular previamente esta solução de ácido clorídrico com um padrão tipo primário (PTP), por exemplo carbonato de sódio puro, com a finalidade de conhecer sua concentração exata, antes de proceder à titulação da amostra problema.
O trabalho experimental começa a partir deste momento e será levado a cabo em duas etapas:
Etapa A - Titulação do HCl com um padrão tipo primário (carbonato de sódio puro) com a finalidade de determinar sua concentração exata.
Etapa B - Determinação da quantidade de carbonato de sódio e bicarbonato de sódio, em uma amostra problema por titulação com o ácido clorídrico cuja concentração exata foi calculada na etapa A.
MATERIAIS
Balão volumétrico de 100,0 mL |
Proveta de 100 mL |
Balões Erlenmeyer de 250 mL |
Béquer de 100 mL |
Bureta de 50,0 mL com torneira de teflon |
Béquer de 250 mL |
Pipeta graduada de 5,0 mL |
Pisseta (frasco lavador) |
Pipetas graduadas de 10,0 mL |
Espátula |
Vidro de relógio |
Pêra de borracha |
Funil |
Bastão de vidro |
Pinças e garras |
Balança analítica de precisão |
REAGENTES |
|
Carbonato de sódio puro (PTP) sólido (PM = massa molar = 105,99 g/mol) |
|
Ácido clorídrico concentrado, 37% em massa, d = 1,19 g.cm-3 |
|
Solução problema (aprox. 100 mL) |
|
Alaranjado de metila |
|
Fenolftaleína |
|
PROCEDIMENTO EXPERIMENTAL
A) Padronização do ácido clorídrico com carbonato de sódio (padrão tipo primário) .
A.1. - Preparar 250,0 mL de uma solução de ácido clorídrico aproximadamente 0,1M (mol/L) a partir do reagente concentrado.
A.2. - Preparar 100,0 mL de uma solução de carbonato de sódio (padrão tipo primário) de concentração precisamente conhecida e adequada para titular com ela o ácido clorídrico, tendo em conta que se a titulação fosse realizada em presença de fenolftaleína, deveríamos utilizar volumes aproximadamente iguais de ambos os reagentes.
A.3.- Pipetar uma alíquota adequada da solução padrão de carbonato de sódio e transferi-la a um erlenmeyer de 250 mL. Adicionar aproximadamente 100 mL de água destilada e algumas gotas de indicador alaranjado de metila. Titular com a solução de ácido clorídrico contido na bureta, agitando constantemente o erlenmeyer, até que a solução troque de cor. Repetir esta operação outras 2 vezes, e anotar o volume de solução de ácido clorídrico gasto em cada uma das titulações.
B) Titulação da mistura problema
Pipetar uma alíquota de 10.0 mL da solução problema e transferi-los para um erlenmeyer de 250 mL, adicionar aproximadamente 100 mL de água destilada e algumas gotas do indicador fenolftaleína. Titular com a solução de ácido clorídrico, agitando continuamente a solução, até que se produza uma troca de color. Anotar o volume de ácido clorídrico gasto. Continuando, adicionar à solução do erlenmeyer, algumas gotas de alararanjado de metila, e continuar a titulação até a primeira mudança perceptível de cor. Anotar o volume de ácido clorídrico gasto.
Dados: Massas atômicas H =1,00; Cl = 35,45: Na = 23,00; C = 12,00; O = 16,00.
pK1(H2CO3) = 6,4 ; pK2(H2CO3) = 10,3 .
PRÁTICA 1: FOLHA DE RESPOSTAS
A) Padronização (titulação) da solução de ácido clorídrico
A.1.1 - Escreva a equação global, balanceada, da reação que ocorre na etapa A.3.
A.1.2- Cálculos realizados para a preparação de 250.0 mL de solução de ácido clorídrico aproximadamente 0,1M (mol/L).
Anotar o volume do ácido clorídrico 37% utilizado para preparar 250,0 mL da solução 0,1M (mol/L)
A.2.1.- Cálculos realizados para determinar a massa teórica de carbonato de sódio (padrão tipo primário) para preparar 100.0 mL da solução padrão.
Anotar a massa teórica calculada de carbonato de sódio (padrão tipo primário) para preparar 100 mL de solução apropriada para titular o ácido clorídrico do item A.1
A.2.2.- Massa do carbonato de sódio (padrão tipo primário), medida (pesada) experimentalmente, para preparar a solução do item A.2
A.2.3.- Cálculos realizados para determinar a concentração da solução padrão tipo primária.
Anotar a concentração exata da solução (padrão tipo primário) do item A.2
A.3.1.- Volume da alíquota retirada da solução (padrão primário) para realizar a titulação
A.3.2.- Em que forma se encontra o indicador no começo da titulação?
[ ] Ácida [ ] Básica
A.3.3.- Volume de HCl gasto em cada titulação:
Titulação 1)
Titulação 2)
Titulação 3)
Volume de HCl que será utilizado nos cálculos.
A.3.4.- Indicar os cálculos realizados para obter a concentração exata da solução de ácido clorídrico.
Concentração exata da solução de ácido clorídrico
B) Titulação da mistura problema
B.1.- Em que forma se encontra o indicador fenolftaleína no começo da titulação
[ ]Ácida [ ] Básica
B.2.- Em que forma se encontra o indicador fenolftaleína depois do primeiro ponto de equivalência:
[ ]Ácida [ ] Básica
B.3 - Volume de ácido gasto em cada uma das titulações com fenolftaleína:
1)
2)
3)
B.4.- Em qual forma se encontra o alaranjado de metila quando ele é adicionado à solução?
[ ]Ácida [ ] Básica
B.5.- Qual é a forma do indicador alaranjado de metila depois do segundo ponto de equivalência?
[ ]Ácida [ ]Básica
B.6.- Volume de ácido gasto em cada uma das titulações com alaranjado de metila.
1)
2)
3)
B.7.- Indicar a(s) reação(ões) que ocorre(m) durante a titulação com a fenolftaleína:
B.8.- Indicar a reação(es) que ocorre(m) durante a titulação com alaranjado de metila.
B.9.- Volume de ácido clorídrico que será utilizado para calcular a concentração de carbonato de sódio
B.10.- Volume de ácido clorídrico que será utilizado para calcular a concentração de bicarbonato de sódio
B.11.- Calcular a concentração molar de carbonato de sódio na amostra problema.
B.12 - Calcular a concentração molar de bicarbonato de sódio na amostra problema.
B.13 - Concentraçao molar de carbonato de sódio
B.14 - Concentração molar de bicarbonato de sódio
B.15 - Se o carbonato de sódio da solução-problema estivesse impurificado com hidróxido de sódio, em lugar de bicarbonato, os volumes de ácido gastos com fenolftaleína e com alaranjado de metila seriam diferentes?
O volume gasto com fenolftaleína seria maior
O volume gasto com alaranjado de metila seria maiorB.16 - Que reações ocorreriam com o indicador fenolftaleína ao titular a mistura de carbonato de sódio e hidróxido de sódio?
B.17 - Que reações ocorreriam com o indicador alaranjado de metila ao titular mistura de carbonato de sódio e hidróxido de sódio?
B.18 - Na tabela do exame experimental são indicados os intervalos de viragem de diversos indicadores, assim como suas cores nas formas ácida e básica. Poderíamos utilizar alguns destes indicadores para realizar estás titulações?
Indicador(es) possível(eis) para substituir a fenolftaleína
Indicador(es) possível(eis) para substituir o alaranjado de metila
B.19 - Dentre as curvas de titulação, apresentadas na folha seguinte, qual representaria melhor a reação de titulação que estamos fazendo com a solução problema?
[ ] A [ ] B [ ] C [ ] D
PRÁTICA 2: PREPARAÇAO DO ACETATO DE ETILA
A prática consiste na preparação do acetato de etila a partir do ácido acético e etanol, mediante uma reação de especificação.
O acetato de etila sintetizado será posteriormente destilado e purificado para permitir o cálculo do rendimento da reação.
Materiais
agitador magnético |
termômetro |
rolha esmerilhada |
coletor |
suporte de cortiça |
espátula |
provetas de 10 mL e de 25 mL |
bastão de vidro |
aro de metal |
tesouras |
funil de filtração a gravidade |
papel de filtro |
Pêra |
balança |
funil de decantação com tampa |
condensador e borrachas para água |
béqueres para precipitados (100 e 250mL) |
pinças, garras e clipes de segurança |
frasco vazio e etiquetado para guardar a substância obtida |
|
balão de fundo redondo com boca esmerilhada de 50 mL |
|
banho de óleo (banho de azeite ou banho de silicone) |
|
cabeça de destilação com adaptador para termômetro |
|
agitador magnético com placa de aquecimento |
|
erlenmeyers de vários tamanhos, limpos e secos |
|
Reagentes |
|
ácido acético |
etanol absoluto |
ácido sulfúrico concentrado |
Na2SO4 anidro |
solução aquosa 10% em massa de Na2CO3 |
|
PROCEDIMENTO EXPERIMENTAL
SÍNTESE DO ACETATO DE ETILA
Em um balão de fundo redondo de 50mL, contendo o agitador magnético, coloque 12mL de ácido acético glacial e 15 mL de etanol absoluto. Colocar cuidadosamente 2 mL de ácido sulfúrico concentrado. Em sua bancada de laboratório você dispõe de quantidades exatas de cada reagente em frascos adequadamente etiquetados.
Montar o sistema de refluxo conforme o desenho apresentado. Prenda o balão de forma segura e conecte a entrada de água na torneira dágua para refrigeração e ligue a saída do destilador ao local de escoamento dágua. Ligue o agitador magnético e aqueça o banho de silicone (ou de óleo ou de azeite) regulando o botão da placa aquecedora na temperatura indicada no aparelho.
Desça o sistema montado até que o conteúdo do balão de destilação esteja completamente submerso no banho de silicone (de azeite ou de óleo). Aqueça a mistura em refluxo por 30 minutos.
Após 30 minutos de refluxo, a reação pode ser considerada como terminada.
NAO DESLIGUE A PLACA DE AQUECIMENTO NEM O AGITADOR MAGNÉTICO PORQUE VOCE TERÁ QUE UTILIZÁ-LAS NOVAMENTE.DESTILAÇAO DO ACETATO DE ETILA
Suspenda o balão de reação do banho de silicone (ou azeite ou óleo) e espere 5 minutos para que seu conteúdo resfrie.
Transforme o sistema de refluxo em um sistema de destilação.
CHAME O PROFESSOR RESPONSÁVEL PARA QUE ELE COMPROVE SE O SISTEMA DE DESTILAÇAO ESTÁ CORRETAMENTE MONTADO E PEÇA PARA QUE ELE ASSINE NA SUA FOLHA DE RESPOSTA.Coloque o balão de destilação no banho de silicone (ou de azeite ou de óleo) e recolha a fração de líquido que destila entre 70-80 oC
Uma vez concluída a destilação, desligue a placa de aquecimento (mas não o agitador magnético) e deixe o sistema esfriar.
VOCÊ PODE CONTINUAR COM A EXECUÇAO DA PRÁTICA E DESMONTAR O SISTEMA DE DESTILAÇAO QUANDO TERMINAR.Não esqueça de desligar a torneira de água que esta ligada ao destilador.
PURIFICAÇAO DO ACETATO DE ETILA
Passe o líquido destilado a um funil de decantação e lave com 10 mL de solução aquosa de Na2CO3 10% e repita a lavagem por mais 2 (duas) vezes. (densidade do acetato de etila = 0,902 g/cm3).
Coloque o acetato de etila em um erlenmeyer limpo e coloque, com uma espátula, uma pequena quantidade de Na2SO4 (anidro).
EM SUA BANCADA DE LABORATÓRIO VOCE DISPOE DE UM FRASCO COM VÁRIOS GRAMAS DE Na2SO4 ( anidro).Agite a mistura cuidadosamente e filtre-a por gravidade sobre o frasco já etiquetado,
QUE FOI ANTERIORMENTE PESADO QUANDO VAZIO.Pese o frasco com acetato de etila. Calcule a massa de substância que você obteve.
Entregue o frasco etiquetado com a substância ao professor responsável para determinação da pureza por RMN-1H.
V Olimpíada Iberoamericana de Química - 1999
EXAME TEÓRICO
Problema 1Para preparar 100 ml de uma solução tampão de pH 4,00 se dispõe, unicamente, de uma solução de ácido acético 0,50mol/L ( Ka= 1,75.10-5 ) e de hidróxido de sódio sólido.
1 - Explicar, por meio das reações químicas correspondentes, como se pode preparar esta solução tampão.
2 - Calcular a massa, em gramas, de NaOH necessária para preparar a solução tampão (supor que a adição de hidróxido de sódio sólido à solução de ácido acético não produz variação de volume).
3 - Calcular as concentrações de ácido acético e de acetato de sódio na solução tampão.
4.1 - Se adicionar 5,0 ml de uma solução de ácido clorídrico 1,0x10-2 mol/L a 20,0 ml da solução tampão preparada, qual será a variação de pH que ocorre? Escreva a equação química correspondente.
4.2 - Calcular a variação de pH que ocorre quando adicionamos 5,0 ml de ácido clorídrico 1,0x10-2 mol/L a 20,0 ml da solução de ácido acético inicial. Escreva a equação química correspondente.
5.1 - Se a outra porção de 20,0 ml da solução tampão adicionar 5,0 ml de uma solução de hidróxido de sódio 1,0x10-2 mol/L qual será a variação de pH que ocorre Escreva a equação química correspondente.
5.2 - Calcular a variação de pH que se produz quando adicionamos 5,0 ml de hidróxido de sódio 1,0x10-2 mol/L a 20 ml da solução de ácido acético inicial. Escreva a equação química correspondente.
6 - Marque a qualidade da capacidade tampão da solução preparada.
Massas molares : Na: 22,99 g mol-1 O: 16,00 g mol-1 H:1,01 g mol-1
Problema 2
I) Os elementos 17 e 20 da tabela periódica formam compostos com o
hidrogênio.
Ia - Indicar o nome, símbolo e configuração eletrônica dos elementos 17 e 20 da tabela
periódica.
Ib - Formular e nomear o composto, no estado gasoso, formado pelo elemento 17 com o
hidrogênio. Escreva a equação química que descreve o comportamento do composto
anterior quando colocado em água.
Ic - Formular e nomear o composto formado pelo elemento 20 com o hidrogênio. Escreva a
equação química que descreve o
comportamento do composto anterior quando colocado em água.
II) Escreva as semi-reações anódica e catódica que ocorrem ao realizar a eletrólise
de:
IIa) HF(l) puro, IIb) H2O(l), IIc) LiH(l) puro.
III) Nem todos os hidretos covalentes podem ser obtidos por meio de processos
exotérmicos, e muitos deles devem ser obtidos por outros métodos, tal como a
protonação de uma base de Brønsted. Desta forma, o PH3 pode ser sintetizado
segundo a equação
seguinte:
Ca3P2 + 3 H2SO4 -------> 2PH3 +
3 CaSO4
IIIa -Indicar as espécies ácidas e básicas presentes na equação anterior.
IIIb - Escreva os nomes, segundo a IUPAC, das espécies seguintes: PH3 e H2SO4.
IIIc - Sabendo que o rendimento deste processo é de 80,00%, qual a massa de Ca3P2
, com 90,00% de pureza, é necessária para preparar 20,0 g de PH3?
IIId - Sabendo que o rendimento deste processo é de 80%, qual o volume de solução de H2SO4
de concentração 2,00 mol/L será necessário para preparar 20,0 g de PH3? .
IIIe - No laboratório, você dispõe de H2SO4 comercial com 98,08%
de pureza e densidade 1,84 g/mL. Que volume de H2SO4 comercial será
necessário para preparar o volume da solução 2,00 mol/L calculado no item anterior.
IV) Muitos outros compostos inorgânicos, não só não podem ser obtidos por métodos
diretos, como as suas sínteses são
acompanhadas por outros processos não desejados, tal como ocorre, por exemplo, com os
oxoácidos e os oxossais dos halogênios. O seguinte diagrama de potenciais mostra algumas
espécies de bromo em meio básico ([OH-] = 1,00 mol/L) e os potenciais padrão
de redução, em volts, correspondentes a cada processo:
IVa) Identificar, se a espécie BrO- é termodinamicamente estável com relação a dismutação das espécies BrO3- e Br-. Justifique sua resposta escrevendo as equações redox e calculando os potenciais.
IVb) Indicar qual valor terá o Eo Br2/Br- no meio ácido.
IVc) Determinar o potencial de redução do íon bromato a brometo.
Problema 3
A síntese dos compostos E e F a partir do 2-butino, requer os seguintes reagentes:
H2; Na; OsO4; acetona; ácido m-cloroperbenzóico; NH3 (liq.); H3O+ ; catalisador de Lindlar (Pd/BaSO4 ou Pd envenenado); ácido não aquoso.
Coloque os reagentes adequados nos quadros acima das setas e indique estrutura e nome dos compostos desconhecidos especificando, quando for o caso, a estereoquímica.
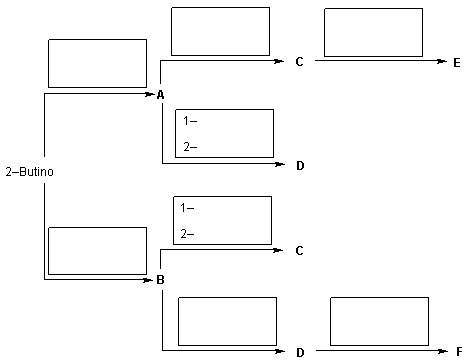
Os compostos E e F são estereoisômeros do 2,2,4,5-tetrametil-1,3-dioxolano. E é um único composto e não é opticamente ativo, enquanto que F é uma mistura racêmica.
Notas
A obtenção de D a partir de A e de C a partir de B, ocorre através de uma seqüência de 2 etapas individuais. Indique, separadamente, os reagentes envolvidos em cada uma das etapas.
Em todos os casos em que for possível obter mais de um estereoisômero, nomeie-os todos, indicando a estereoquímica e desenhe suas estruturas.
Alguns reagentes podem ser utilizados mais de uma vez.
Alguns reagentes podem ser usados de forma associada em uma mesma reação.
Folha de respostas (Problema 3) |
|||
| A | B | ||
Nome:
|
Estrutura | Nome: |
Estrutura |
| C | D | ||
Nome: |
Estrutura | Nome: |
Estrutura |
E |
F | ||
Nome: |
Estrutura | Nome: |
Estrutura |
Problema 4
Um composto químico, utilizado habitualmente como anestésico, é absorvido pelo corpo humano, a uma velocidade proporcional à sua concentração na corrente sangüínea. Supondo que um paciente necessita de uma dose de 10,0 mg de anestésico por kg de peso, para manter a anestesia a um nível mínimo durante uma intervenção cirúrgica.
Calcule a quantidade, em mg, que se deverá administrar a um paciente de 50,0 kg para mante-lo corretamente anestesiado durante uma operação que irá durar 2,5 horas. Assuma que o anestésico se introduz na corrente sangüínea do paciente numa única injeção, e que à temperatura de 36ºC este desaparece à velocidade de 0,20% por minuto.
Se a energia de ativação do processo de absorção do anestésico é de 64,5 kJ/mol, calcule qual seria a dose a administrar, ao mesmo paciente, se a sua temperatura corporal fossem 40ºC.
Problema 5
Introduzem-se 4,40 g de CO2 em um recipiente de 1,00 L que contêm carbono sólido em excesso, a 1000 K, de modo que se alcance o equilíbrio CO2(g) + C(s) = 2CO(g). A constante de equilíbrio, KP, para esta reação, a 1000 K, é 1,90. Considere o comportamento de gás ideal.
(a) Calcular a pressão total (em bars) no equilíbrio.
(b) Se, uma vez estabelecido o equilíbrio, for introduzida uma quantidade adicional de He(g) até duplicar a pressão total, qual é a quantidade de sustância de CO no equilíbrio, nestas novas condições?
(c) Se, uma vez alcançado o equilíbrio no item a) se duplica o volume do recipiente, introduzindo He(g) para manter a pressão total, que quantidade de sustância (moles) de CO haverá no equilíbrio, nas novas condições?
(d) Se a quantidade inicial de C(s) no recipiente for 1,20g, que quantidade de sustância (moles) de CO2 deveríamos introduzir de modo a que no equilíbrio só restem traços (vestígios) de carbono (10-5 g).
(e) Se ao aumentar a temperatura em 10ºC a constante de equilíbrio duplica, qual será o valor do D Hº para a reação, supondo que o valor desta grandeza se mantém constante no intervalo de temperaturas considerado?
(f) A 1000 K, a pressão de CO2 em equilíbrio com CaCO3(s) e CaO(s) é igual a 3,90 kPa. Misturam-se C, CaO e CaCO3 e deixa-se que alcancem o equilíbrio a esta mesma temperatura em um recipiente fechado e inicialmente vazio. Qual é a pressão de CO (em bars) no equilíbrio?
Dados: R = 8,314 J K-1 mol-1. R = 0,08206 atm L K-1 mol-1.
Massas molares: C = 12,01 g mol-1, O = 16,00 g mol-1.
p0 = 1bar 1bar = 105 Pa = 0,9869 atm