Bogotá, outubro 1998
Prova Teórica
Questão 1
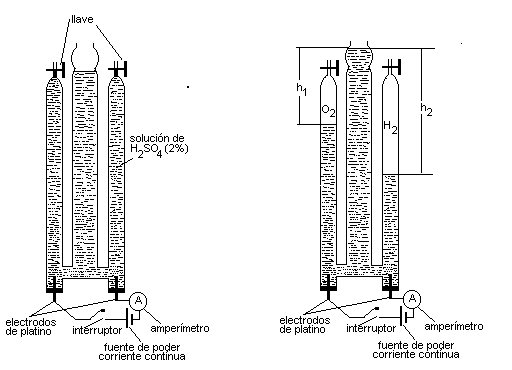
Um estudante de Química realizou a eletrolise da água mediante o instrumento descrito na figura abaixo, onde se mostram os estados inicial e final do processo. A solução foi previamente saturada com gases hidrogênio e oxigênio. O diagrama apresentado não está em escala.

Estado Inicial Estado Final
As condições de trabalho e as medidas realizadas são indicadas a seguir:
Temperatura : 20oC Intensidade de corrente: 0,100A
Pressão atmosférica: 560 mmHg ( 7,464x104 Pa) Tempo : 20 min.
Densidade solução H2SO4:
1,015 g/mL Volume de hidrogênio : 20,16 cm3Carga do elétron: 1,602x10-19 C Valor altura h2 : 290 mm
Densidade do mercúrio: 13,6 g/cm3 Pressão de vapor da água: 17,5 mmHg (2,332x103 Pa)
Valores para a constante R : 0,082 L. atm./mol. K ; 8,314 J/mol. K ou 8,314 kPa. dm3./mol. K
Use o valor de R mais conveniente para você
Q = I x t onde: Q : quantidade de corrente ( em coulomb).
I : intensidade de corrente (ampère) t : tempo (segundos)
Expresse os resultados com algarismos significativos adequados.
Com base na informação anterior responda as seguintes perguntas:
1. Equações de reações do processo:
a) catódica :
b) anódica:
2. Calcule a quantidade de hidrogênio produzido (em mols) supondo comportamento ideal do gás:
3. Tendo em conta a informação disponível, calcule o valor da constante de Avogadro
4. Tendo em conta a informação disponível, calcule o valor experimental da constante de Faraday.
5. Se o oxigênio produzido durante o processo reage com excesso de enxofre, que volume de dióxido de enxofre gasoso se obtém nas mesmas condições em que se recolheu o hidrogênio no processo de eletrólise ?
a) Equação da reação.
b) Calcule o volume de SO2(g) produzido, supondo comportamento ideal do gás
Questão 2
Uma amostra de 1,802 g de um composto que contem somente carbono, hidrogênio e oxigênio, foi queimada totalmente na presença de oxigênio e foram obtidas 3,961 g de CO2 e 0,7206 g de H2O. Ao dissolver a mesma quantidade da amostra em água ate se obter 0,100 L de solução, esta apresentou uma pressão osmótica de 2,460 atmosferas a 27,0oC. Determinar a fórmula molecular do composto. Expressar o resultado final com três algarismos significativos.
Massas molares relativas: C : 12,01 H : 1,008 O: 15,99 Pressão osmótica ? = (n/V)RT
a) Cálculo da fórmula empírica.
b) Calcule a massa molar e expresse o resultado com algarismos significativos apropriados.
c) Cálculo da fórmula molecular (FM).
Questão 3
Em um recipiente de vidro coloca-se 50,00 mL de acido acético (96,00% em massa, densidade d = 1,060 g/mL); 50,00 mL de álcool etílico (96,00 % em massa, densidade = 0,8028 g/mL); 50,00 mL de acetato de etila (100 % em massa, d = 0,9010 g/mL); 50,00 mL de acido clorídrico (8,490 % em massa, d = 1,040 g/mL) e 20,00 mL de água pura (d = 0,9982 g/mL). A mistura atinge o equilíbrio segundo a reação:
. HCl
CH3COOH(aq) + C2H5OH(aq) <=> CH3-CO-O-C2H5 (aq) + H2O(l)
O acido clorídrico (HCl) atua como catalisador. Observe a água como produto da reação.
Toma-se uma alíquota de 20,00 mL da mistura em equilíbrio e se titula na presença de fenolftaleína, consumindo-se 88,02 mL de NaOH 1,000 mol/L. Determinar o valor da constante de equilíbrio (K) do sistema.
Massas atômicas relativas:
H : 1,008 C : 12,01 O : 15,99 Cl : 35,45
a) Calcule as quantidades iniciais (em mols) de ácido acético, etanol, acido clorídrico, e éster.
b) Calcule as quantidades (em mols) de todas as espécies no equilíbrio.
c) Escreva a expressão da constante de equilíbrio e calcule seu valor.
Questão 4
Dada a seguinte equação química :
[Cu(NH3)4]Cl2 + KCN + H2O => NH3 + NH4Cl + K2[Cu(CN)3] + KOCN + KCl
faz-se reagir 810,28 g de [Cu(NH3)4]Cl2 com 1098,9 g de KCN com 80,00% de pureza. O rendimento desta reação é de 60,00%.
Massas atômicas relativas: Cu : 63,54 H : 1,008 N : 14,01 K : 39,10 C : 12,01 Cl : 35,54
a) Escreva as estruturas de Lewis para a molécula de KOCN e de NH4Cl.
Números atômicos:
ZC = 6; ZCl = 17 ; ZN = 7 ; ZK = 19 ; ZCu = 29 ; ZH = 1 ZO = 8
b) Faça o balanceamento da equação, indicando as espécies que se oxidam e as que se reduzem.
c) Determine a quantidade (em mols) dos reagentes e do reagente limitante.
d) Determine a massa de amoníaco produzida (em gramas) e expresse o resultado com os algarismos significativos apropriados.
e) Que volume de amoníaco líquido se obtém, sabendo que sua densidade a -33oC tem o valor de 0,6830 g/cm3.
f) Nomeie ( segundo a IUPAC) os compostos a seguir, os quais participam das reações estudadas.
K2[Cu(CN)3] ; KOCN ; NH4Cl
Questão 5
A ciclohexanona é uma cetona cíclica que como toda cetona se reduz com hidreto de Lítio e Alumínio (LiAlH4) na presença de éter, para dar origem ao ciclohexanol, álcool secundário que se desidrata facilmente na presença de H2SO4 concentrado, para dar ciclohexeno.
1. Escreva as equações correspondentes as reações descritas no parágrafo anterior.
2. Como você distinguiria em laboratório a ciclohexanona do ciclohexanol através de um único teste que venha a produzir mudança de cor, formação de precipitado etc., não sendo necessário para isto escrever as equações:
a) ciclohexanona do ciclohexanol.
b) ciclohexanona do ciclohexeno.
c) ciclohexanol do ciclohexeno.
d) Como fazer a diferença de um álcool primário de um álcool secundário ?
3. Que tipo de redução você empregaria para obter o ciclohexano a partir da ciclohexanona. ( Explique como se obtém e escreva as estruturas correspondentes).
4. O ciclohexeno reage de diferentes formas. Caso se trate com ozônio (O3) seguido de Zinco (Zn) em pó e água obtém-se um aldeído, o qual é oxidado facilmente com permanganato de potássio em meio ácido, obtendo-se um ácido dicarboxílico.
a) Escreva as equações das reações indicadas no parágrafo anterior.
b) Qual é o volume de hidróxido de sódio 1mol/L (NaOH) que você precisa para titular 146mg do ácido do item anterior?
5. Caso o ciclohexeno seja tratado com uma solução de bromo em tetracloreto de carbono (Br2 / CCl4), se obtém o composto A. Escreva a equação correspondente a reação descrita e o nome e a estrutura do produto. Indique o isomero geométrico preponderante.
6. O ciclohexeno também pode ser halogenado com bromo na presença de luz UV, produzindo um composto B. O composto B reage com ácido m-cloroperbenzóico (MCPBA) na presença de diclorometano (CH2Cl2) para dar um epóxido.
a)Escreva a equação correspondente da reação indicando a estrutura e nome do epóxido (sem estereoquímica)
7. Quando o epóxido é tratado com metanol em meio ácido se obtém o 3-bromo-2-metoxiciclohexanol .
Escreva a equação correspondente a reação descrita acima.
8. Por oxidação do composto trisubstituído se obtém o composto C, a partir do qual se obtém um álcool terciário pela reação
, com cloreto de ciclohexilmagnesio seguido de hidrólise em meio ligeiramente ácido. Escreva a equação correspondente a reação descrita acima e o nome do álcool terciário.9. O álcool terciário formado é desidratado em meio ácido, para dar uma olefina que por ozonólise origina duas cetonas : 2-metoxi-3-bromo-ciclohexanona e ciclohexanona. Qual é a estrutura da olefina e dos compostos cetônicos formados?
Questão 6
O benzoato de 2-naftila hidrolisa em meio ácido dando dois produtos:
1º) Escreva a reação de hidrólise do benzoato de 2-naftila.
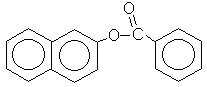
A B C
2º) Caso a reação seja incompleta e os produtos estejam impurificados com o composto de partida, complete o esquema de separação, levando em conta que: o produto B é o ácido maior acidez.
# Dispomos de solução aquosa de hidróxido de sódio, bicarbonato de sódio e ácido clorídrico.
Temos ainda as seguintes convenções:
(+) adição de reagentes.
( ): Operação ou operações de laboratório necessárias (Exemplo: filtração, decantação, etc.)
O produto B é o de maior acidez
Temos ainda as seguintes convenções:
(
+) : adição de reagentes(=>) :
): Operação ou operações de laboratório necessárias (Exemplo: filtração, decantação, etc.)( ) :
) Compostos obtidos nesta etapa do processo.NOTA ! :
Todos os compostos são sólidos insolúveis em éter etílico.NOTA 2:
No diagrama todos as partes que ficam a esquerda correspondem a fase aquosa, e aqueles que se encontram a direita correspondem a fase etérea.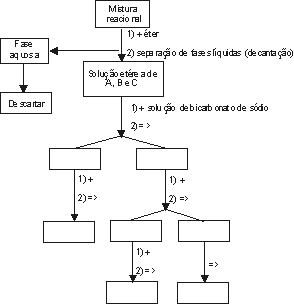
3o. Por separação cromatográfica da mistura de reação se obtém o seguinte cromatograma
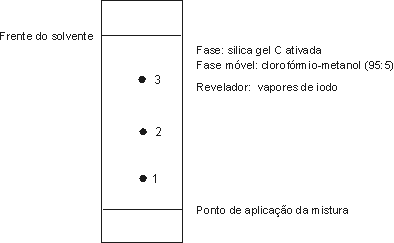
a) Associe cada mancha na placa ao composto correspondente e determine o Rf correspondente.
Mancha Nome do composto valor do Rf
1 ___________________________________ ______
2 ___________________________________ ______
3 ___________________________________ ______
b). De acordo com o que foi visto anteriormente diga se é FALSO ( F) VERDADEIRO. (V) as seguintes afirmações. Escreva no quadro correspondente a opção escolhida.
- Predomina o mecanismo de partição (partição ou distribuição).
- Predomina o mecanismo de adsorsão :
- A fase estacionária é polar e a fase móvel é de baixa polaridade :
-
Os valores de Rf dependem principalmente da polaridade dos compostos- Os valores de Rf dependem principalmente da solubilidade dos compostos na fase móvel .
Prova Experimental
PROVA PRÁTICA Nº 1
Leia atentamente o procedimento e todas as perguntas antes de realizar a prática.
O cobre é um elemento que forma uma grande variedade de compostos, mediante inúmeras reações e aplicando alguns procedimentos e operações básicas de laboratório. Por exemplo, o cobre elementar reage com ácido nítrico concentrado obtendo-se uma solução (reação 1), a partir desta solução em meio alcalino se obtém um precipitado (reação 2) que por aquecimento suave muda de cor (reação 3). Este por reação com solução ácido sulfúrico 2M da lugar a uma solução colorida (reação 4), a partir da qual da qual se obtém cobre elementar por reação de deslocamento com zinco metálico em pó (reação 5), completando-se desta maneira um ciclo.
PROCEDIMENTO
Você receberá uma amostra de cobre metálico, que após a realização de todas as etapas do ciclo deverá ser recuperado e secado para que possa ser pesado pelo professor. Estas etapas podem ser efetuadas em um mesmo recipiente, evitando-se assim a transferencia de sólidos e soluções. Entretanto, as operações pertinentes devem ser realizadas com o máximo cuidado possível para manter o nível de pureza do ciclo em cada um de suas etapas..
No desenvolvimento de seu trabalho você deve seguir os passos indicados a seguir:
Para iniciar as reações utilize a montagem mostrada abaixo. O ácido nítrico que será utilizado no primeiro passo da seqüência se encontrará no tubo com saída lateral. Ao adicionar o cobre metálico você deve fechar o tubo rapidamente para evitar a contaminação do laboratório com gases e proceder tal como mostrado no esquema.
Após a finalização da reação 1, destampe o tubo na capela e adicione rapidamente 10mL de água destilada (aproximadamente). A solução resultante será transferida para um béquer de 30 mL. Neste mesmo recipiente serão realizadas as reações subsequentes.

NOTAS :
1. Leve em conta que para uma boa realização do ciclo você deve eliminar, mesmo que parcialmente, o excesso de reagentes em um ou mais passos do processos.
2. Em caso de acidente, você poderá pedir uma segunda amostra de cobre ao professor.
Escreva a reação 1.
Fatos observados:
Escreva a reação 2.
Fatos observados:
Como pode estabelecer que a reação terminou?
Escreva a reação 2.
Fatos observados:
Como pode estabelecer que a reação terminou?
Precipitado + solução de ácido sulfúrico.Fatos observados:
Escreva a reação 5.
Fatos observados:
Como pode estabelecer que a reação terminou?
6.Determinacao da massa de cobre seco recuperada.
Massa de cobre obtida:
Procedimento seguido para a obtenção do cobre seco:
Enumere todas as operações realizadas para obter o cobre livre de impurezas e seco
7. Represente com um diagrama o "Ciclo do Cobre" realizado.
8. Na etapa No. 5 se emprega Zinco em pó ;
9. Caso na etapa 2 houvesse necessidade de separar rapidamente o sólido formado, que método você empregaria?
10. Por que é necessário diluir a solução obtida na etapa 1 antes de passar para as etapas subsequentes ?
PROVA PRÁTICA Nº 2
Um estudante muito curioso observando um isqueiro pensou : estes isqueiros trabalham a gás, entretanto o que se vê dentro é um líquido. Por outro lado, quando se abre a válvula ouve-se o ruído do gás ao sair, e se detecta seu odor. Será possível conhecer algo sobre o gás do isqueiro? Estas dúvidas foram questionadas ao seu professor de ciências, que lhe respondeu :
Certamente. Poderias calcular a sua massa molar e também o valor da constante R dos gases ideais. É suficiente coletar uma amostra do gás por deslocamento de água, tomar as medidas e fazer os cálculos necessários, supondo que é butano e que tem comportamento ideal ; demais é conhecida a temperatura e a pressão atmosférica no lugar do trabalho, a pressão de vapor da água (14,5 mmHg) e a densidade do mercúrio (13,6 g/cm3).
Você dispõe do isqueiro com um adaptador que facilita a manipulação do gás, e de todos os demais elementos que precisa para obter a informação necessária : proveta, cubeta para água, balança, régua. Expresse o resultado com dois algarismos significativos. As pesagens serão realizadas pelo professor.
1º Indique o procedimento a seguir com os elementos que tem a sua disposição, justificando cada passo.
Como orientação, leve em consideração que você pode conhecer : a massa, o volume, e a quantidade de substancia (número de mols)..
2º Efetue as medidas necessárias e calcule o valor da constante R. Indique, detalhadamente, os cálculos realizados.
3º A composição da mistura de gases do isqueiro é conhecida. Pede-se calcular, novamente, o valor de R. Como você procederia? .
n-Butano : 87,5% ; Propano : 9 % ; n-Pentano : 3,5 %
Descreva o procedimento alternativo proposto:
4º Que explicação pode dar ao fato de que dentro do isqueiro vê-se um líquido e quando abrimos a válvula sai um gás?
5º Indique três condições e/ou características que devem possuir a mistura de gases para realizar o trabalho proposto.