1a OLIMPIADA IBERO-AMERICANA DE QUIMICA
Mendoza, 1 a 7 de outubro, 1995
EXAME TEÓRICO, aplicado em 05.10.95 (10h as 15h)
Problema N° 1:
Por um processo de refino do mineral bauxita dissolvido em criolita fundida, se obtém alumina (Al2O3). O alumínio é obtido por eletrólise de alumina. O processo se realiza a 1.000°C utilizando um cátodo de alumínio líquido e um anodo de grafite. Tanto no cátodo como no anodo reagem espécies de O2- .
a) Escreva a fórmula química de duas espécies, diferentes de O2- , que participem deste processo, e contenham oxigênio no estado de oxidação -2.
b) Escreva a reação que ocorre no cátodo e a que ocorre no anodo.
c) Que massa de alumina é necessária para obter 1 kg de alumínio?
d) O potencial termodinâmico para a redução de alumina (Al2O3) nessas condições é de 1,2 V. Porém, o processo se realiza a 4,7 V e com correntes que chegam a 13.000 A, com uma eficiência global de conversão de 35%. A baixa eficiência do processo se deve a limitações da tecnologia e não à ocorrência de outras reações. Em quanto tempo se obtém 1 kg de alumínio quando se utiliza corrente máxima? A carga que circula num circuito é o produto da intensidade de corrente pelo tempo em que esta carga circula.
e) Que massa inicial deve ter o anodo de grafite a fim de reduzir completamente 2,5 kg de alumina?
f) É possível obter depósitos de alumínio por eletrólise de soluções aquosas ácidas de Al3+(aq)? Justificar a resposta.
Em um meio moderadamente ácido, se forma Al(OH)3(s) a partir de uma solução que contém Al3+(aq). A constante de equilíbrio desta reação é 2,0x1032. Se o meio é fortemente alcalino, o Al(OH)3(s) se dissolve resultando outras espécies que contêm alumínio. A constante de equilíbrio desta outra reação é 40.
g) Escreva as equações químicas que descrevem o equilíbrio de solubilidade do hidróxido de alumínio Al(OH)3 em soluções ácidas e básicas.
h) Há maior concentração de espécies dissolvidas, que contenham aluminio, em uma solução de pH=1 ou em uma de pH=13? Justificar a resposta.
Dados:
Ar: Al = 27 O = 16 C = 12
Potenciais normais de redução a partir do Potencial Padrão de Hidrogênio
Al3+(aq.) / Al (s) = -1,66 V. O2 (g) / H2O = + 1,23 V H+(aq.) / H2(g) = 0 V.
Constante de Faraday: 96500 C/mol
Problema N° 2:
a) Existem vários fluoretos de enxofre, todos eles gasosos. O S2F2 existe em duas formas isómeras. Proponha uma estrutura para cada um dos isómeros.
b) A reação do tetrafluoreto de enxofre com flúor resulta no produto principal hexafluoreto de enxofre e em menores quantidades de decafluoreto de dienxofre. Escreva a equação química correspondente à obtenção de cada um destes produtos.
c) Em um recipiente isolado termicamente e de volume constante, se colocam 100 mmHg de tetrafluoreto de enxofre e 60 mmHg de flúor. Quando a reação se completa, observa-se que todo o flúor foi consumido e que a pressão final total é de 90 mmHg. Calcular as pressões parciais de cada uma das espécies, no final da reação. Suponha que este sistema gasoso se comporta idealmente.
d) O tetrafluoreto de enxofre é muito reativo em presença de umidade, mas o hexafluoreto de enxofre é um composto muito estável nessas condições. Calcule o valor de D G° para a reação de hidrólise de um mol de hexafluoreto de enxofre a 298K.
Considere que a hidrólise do hexafluoreto de enxofre resulta trióxido de enxofre e fluoreto de hidrogênio.
e) A estabilidade do hexafluoreto de enxofre é termodinâmica ou cinética? Justificar a resposta.
f) Por que não existem os compostos homólogos do hexafluoreto de enxofre com cloro, bromo ou iodo?
Dados: (todos os compostos são gasosos)
Composto |
D Hf° / kJ.mol-1 |
Sf° / J.K-1.mol-1 |
SF6 |
-1.220,5 |
291,5 |
HF |
-273,3 |
173,8 |
H2O |
-241,8 |
188,8 |
SO3 |
-395,7 |
256,8 |
Problema N° 3:
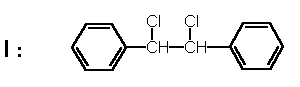
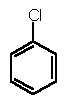
O composto I tem a seguinte estrutura:

1. Dê seu nome de acordo com a nomenclatura sistemática de IUPAC.
2. Indique qual é a hibridação de cada um dos átomos de carbono presentes na molécula.
3. Indique quais átomos da molécula se encontram em um mesmo plano.
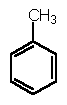
4. A distância das ligações carbono-carbono nos anéis benzênicos de I são todas iguais e com valor 1,39 Å. Pode-se calcular que este valor corresponde a uns 50% de caráter da ligação dupla. Justifique brevemente este fato experimental utilizando o tolueno como modelo . Escreva as fórmulas que demonstrem sua justificativa.
5. A distância da ligação carbono-cloro em I é 1.76 Å. Mas, se o cloro estivesse unido diretamente ao anel benzênico, como no clorobenzeno, essa distância seria de 1,69 Å, que corresponde a uns 16% de caráter da ligação dupla. Justifique este fato experimental, usando como modelo o clorobenzeno e utilizando fórmulas.
6. Existem três formas estereoisoméricas do composto I, das quais duas delas apresentam atividade óptica. Escreva a projeção de Fischer de cada um destes estereoisómeros. Indique os que apresentam atividade óptica e aquele que não apresenta. Neste último caso, justifique sua resposta. Indique que tipo de relação estereoisomérica existe entre eles (enantiómeros, diastereisómeros).
7. Para o estereoisómero dos indicados no ítem 6, que não apresenta atividade óptica, desenhe as fórmulas de Newman de: i. duas conformações alternadas;
ii. duas conformações eclipsadas;
exemplo de fórmula de Newman
iii. a conformação de maior energia;
iv. a conformação de menor energia.
(Para deduzir o tamanho relativo dos diferentes substituintes, utilize os dados fornecidos ao final).
8. Um dos estereoisómeros de I tem um momento dipolar m = 1.27 D, enquanto todos os outros estereoisómeros têm um momento dipolar maior que 2.7 D. Indique a que estereoisómero corresponde o menor valor de m . Justifique. (Lembre-se: m da ligação C-Cl : 2.3 D)
Dados:
Valor dos raios covalentes (em Å) para os átomos envolvidos:
H : 0.30; C(ligação simples): 0.77; C(ligação dupla): 0.66; C(ligação tripla): 0,60; Cl: 0.99
Distância de ligação (em Å) :
C-H: 1.07; C-C (simples): 1.54; C=C (dupla): 1.34; Cº C (tripla): 1.20; C-Cl: 1.79;
C-Cl(clorobenzeno): 1.69; C-H (clorobenzeno): 1.08; C-CH3 (tolueno): 1.50;C-H (tolueno): 1.08
Momento dipolar (em Debye) das ligações : C - H : 0.40 D; C - Cl : 2.3 D
Problema N° 4:
Um método possível para eliminar contaminantes orgânicos em águas naturais se baseia na fotocatálise, utilizando o dióxido de titânio (TiO2 ) como catalizador e a radiação UV-visível proveniente do sol.
Realizou-se um estudo cinético da fotodegradação do ácido salicílico. Determinou-se, prévia e experimentalmente, que a degradação converte totalmente o ácido salicílico em CO2 e H2O.
O procedimento experimental consiste em reagir 25 ml de uma solução 7,24.10-4M de ácido salicílico com 0,0125 g de pó de TiO2 , estabilizando o pH = 3,60 sem modificação perceptível do volume. A solução se satura com oxigênio (P =1 atm) durante todo o período de exposição à radiação. Nestas condições a solubilidade do oxigênio é 0,266 10-3M. Uma vez equilibrado o sistema, ilumina-se durante um tempo t com uma lâmpada de Xenônio, após o que se corta a iluminação; filtra-se a suspensão, realiza-se uma dilução 1:10 do filtrado e determina-se, por espectofotometria de absorção, a concentração do ácido salicílico no mesmo. Neste intervalo de concentração de ácido salicílico, se cumpre a Lei de Lambert-Beer.
Obteve-se o seguinte resultado a 25 ° C :
t (min) |
0 |
10 |
40 |
60 |
90 |
A= absorbância |
0,259 |
0,236 |
0,168 |
0,123 |
0,055 |
a) Qual a ordem de reação com respeito ao ácido salicílico?
Se necessário, utilize papel milimetrado
b) Qual é a concentração de ácido salicílico na solução quando esta amostra se mantém sob iluminação durante 30 minutos? .
c) Que substância se oxida e qual se reduz ?
d) Se num experimento alternativo, conclui-se que a reação é de primera ordem para oxigênio, qual seria a concentração de ácido salicílico em solução quando uma amostra de concentração inicial de ácido salicílico 7,24 x 10-4 M se mantém sob iluminação durante 40 minutos em uma solução saturada com ar ? ( O ar tem 20% V/V de O2).
Problema N° 5:
O sangue tem um pH que se mantém estável em ± 0,02 unidades em torno de um valor normal de 7,40. Este pH é mantido por um sistema ácido-base de carbonatos, fosfatos e de aminoácidos das proteínas.
a) Em pH normal, a [HCO3-] no sangue é 0,024M. Qual é a [CO32-] e a pressão parcial de CO2 em equilíbrio com o sangue a 37°C ?
b) A concentração total de fosfatos no sangue é de 1,0.10-3 M. Calcule a concentração das 4 espécies de fosfato inorgánico no sangue em pH normal.
c) A degradação de hidratos de carbono e lipídios produz espécies ácidas, que tendem a diminuir o pH. Calcule a mudança de pH que seria produzida ao acrescentarmos 0,001 mol de H+(aq) em um volume de 5 L das seguintes soluções :
i) [HCO3-]= 24.10-3 M; [CO2(aq)] = 2.10-3 M;
ii) [H2PO4-] = 0,36.10-3 M; [HPO42-] = 0,64.10-3 M.
Que sistema tem maior poder regulador nestas condições ?.
Dados:
H3PO4: pKa1 = 2,12 H2CO3: pKa1 = 6,38* KH(37°C) = 2000atm
pKa2 = 7,21 pKa2 = 10,32 pKa3 = 12,67
* Considerar CO2(aq) como a espécie ácida.
Problema N° 6:
Além dos métodos espectroscópicos, utilizam-se reações de degradação como método para determinar a estrutura de um composto, isto é, a ruptura da molécula em fragmentos menores facilmente identificáveis. Uma reação deste tipo é a ozonólise.
Reagiram com ozônio, em condições oxidativas, quatro compostos: A, B e C, isómeros de fórmula C7H13Cl, e 1-fenil-2-metil-propeno, obtendo-se os produtos indicados em cada caso:
I)
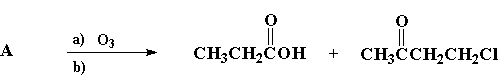
II)
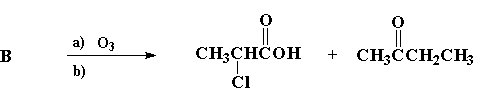
III)
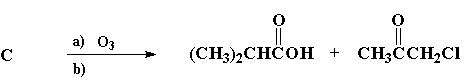
IV)
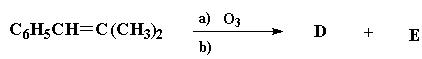
O ácido carboxílico D foi tratado com PCl5 resultando um composto F que, por reação com G resulta N-fenilbenzamida.
Por outro lado, o 1-fenil-2-metil-propeno foi submetido a uma reação de adição de brometo de hidrogênio nas seguintes condições :
a) na escuridão,
b) na presença de peróxido de hidrogênio, obtendo-se H e I.
Os produtos H e I são compostos isómeros
1. Escreva a estrutura de cada um dos isómeros A, B e C.
2. É única a identidade dos compostos A, B e C? Justifique a resposta
3. Proponha uma ordem de acidez para os ácidos carboxílicos obtidos por ozonólise de A, B e C.
4. Justifique a ordem de acidez dada no ítem 3.
5. Escreva a estrutura dos produtos (D e E) obtidos por ozonólise de 1-fenil-2-metil-propeno.
6. Mencione o reagente utilizado no segundo passo da reação com ozônio.
7. Escreva as estruturas de F e G.
8. Explique em qual dos dois anéis da N-fenilbenzamida se produzirá mais facilmente uma substituição eletrofílica aromática.
9. Justifique, mediante estruturas de ressonância, as possíveis posições onde pode ocorrer a substituição eletrofílica aromática do ítem anterior.
10. Escreva as estruturas dos compostos H e I, obtidos por adição de brometo de hidrogênio ao 1-fenil-2-metil-propeno.
11. Explique a que se atribui a diferença entre os produtos H e I.
Folha de Respostas dos Problemas Teóricos
Problema N° 1:
a) fórmula química de duas espécies que contenham oxigênio em estado de oxidação -2 e que participam neste processo.
b) a reação no anodo é :
a reação no cátodo é :
c) São necessários _________kg de alumina
d) Obtém-se 1 kg de alumínio operando com a corrente máxima em ________ minutos.
e) A massa inicial do anodo de grafite deve ser maior que _____________g
f) Envolver com um círculo a resposta correta:
SIM NÃO
justificativa :
g) O equilíbrio de solubilidade do hidróxido de alumínio Al(OH)3 é,
em soluções ácidas :
em soluções básicas :
h) Há maior concentração de espécies dissolvidas que contenham alumínio em uma solução de pH = _______
justificativa
Problema N° 2:
a) estrutura do isómero:
b) equação química:
c) a pressão parcial de SF4 é: ________ mmHg .
a pressão parcial de SF6 é: ________ mmHg .
a pressão parcial de S2F10 é:_________ mmHg .
d) Reação de hidrólise do hexafluoreto de enxofre D G° = ___________
e) Envolver em um círculo a resposta correta.
A estabilidade do SF6 é termodinâmica ou cinética ?
justificativa :
f) Não existem os compostos homólogos do hexafluoreto de enxofre com cloro, com bromo ou com iodo, por que.
Problema N° 3:
1.
2.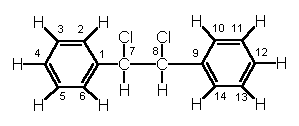
| carbono | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| hibridação |
Nota : utiliza-se uma numeração arbitrária para facilitar a correção do problema
3.
Nota : utilize a numeração indicada na resolução do ítem anterior.
4. Justificativa :
5. Justificativa :
6.

A B C
Atividade óptica: A: B: C:
Justificativa :
Relação estereoisomérica: A - B : A - C : B - C :
7.

A B C D
i : alternadas :
ii : eclipsadas :
iii : conformação de maior energia :
iv : conformação de menor energia :
8. Estereoisómero de menor momento dipolar :
Problema N° 4:
a) A ordem de reação com respeito ao ácido salicílico é _______
b) a concentração de ácido salicílico na solução quando esta amostra se mantém sob iluminação durante 30 minutos é _________M.
c) se oxida: ___________ se reduz:___________
d) A concentração de ácido salicílico em solução é _________ M
Problema N° 5:
a) A [CO3-2] a 37°C é : __________M
A pressão parcial de CO2 em equilíbrio com o sangue a 37°C é _________atm
b)
espécie |
concentração/M |
| . | . |
| . | . |
| . | . |
| . | . |
c)
solução |
D pH |
(i) |
. |
(ii) |
. |
nestas condições a solução _______ tem maior poder regulador.
Problema N° 6:
1a OLIMPIADA
IBERO-AMERICANA DE QUIMICA
Mendoza, 1 a 7 de outubro, 1995
EXAME
EXPERIMENTAL, aplicado em 03.10.95 (10h as 15h)
TRABALHO PRÁTICO Nº 1:
Introdução:
Em uma solução ácida se produz a reação de óxido-redução entre o Fe(III) e o cloreto de hidroxilamônio (NH3OH)Cl. O Fe(III) se reduz a Fe(II), enquanto o cloreto de hidroxilamônio se oxida.
O objetivo desta prática é o de identificar o produto nitrogenado obtido e determinar a estequiometria da reação (i).
Reagentes:
Procedimento:
1) Diluir o KMnO4 1:10 com água destilada.
2) Com ajuda da bureta adequada para este fim, colocar em um Erlenmeyer de 250 mL, um volume de solução de Na2C2O4, de forma que sejam utilizados de 13-15 mL de KMnO4 0.02 M para o cálculo da concentração desejada. Acrescentar 3 mL de H2SO4 (1+1). Aquecer entre 60º e 80°C.
3) Iniciar a titulação com a solução de permanganato diluída previamente, de forma lenta. As primeras gotas demoram a descolorar. Continuar a titulação a quente, até que uma leve coloração rosa permaneça constante por mais de meio minuto.
4) Deve-se repetir a experiência e trabalhar com a média dos resultados. Em caso de dúvida, pode-se realizar uma terceira determinação. Não será concedido tempo adicional.
b) Determinação da estequiometria da reação (i):
1) Colocar em cada Erlenmeyer 10.00 mL de solução de cloreto de hidroxilamônio 0.0700M com pipeta volumétrica. Acrescentar 25 mL de solução de Fe(III) com uma proveta. Aquecer os Erlenmeyers, fervendo suavemente por 2 minutos, a fim de acelerar a reação. Colocar em seguida uns 50 mL de água destilada e 5 mL de ácido fosfórico 6M (a finalidade deste último é a de descolorar o Fe(III), tornando mais nítido o ponto final).
Deve-se repetir a experiência e trabalhar com a média dos resultados. Em caso de dúvida pode-se realizar uma terceira determinação. Não será concedido tempo adicional.
2) Titular com a solução de permanganato diluída, até observar o ponto final de leve coloração rosa permanente, como no ítem (a).
RELATÓRIO DO TRABALHO PRÁTICO Nº 1
USO DO KMnO
4 COMO TITULANTE. ESTEQUIOMETRIA DA REAÇÃO Fe(III) - Cloreto de Hidroxilamônio. A) CONCENTRAÇÃO DE UMA SOLUÇÃO DE KMnO4 0,02 M:Equilibrar a equação :
MnO4- + C2O42- + H+ --------> Mn2+ + CO2 + H2O
Ensaio 1 Ensaio 2
Volume de solução padrão de Na2C2O4 ___________ ___________
Volume de KMnO4 utilizado ___________ ___________
Valor experimental para a molaridade do KMnO4 ___________ ___________
Molaridade do KMnO4 : __________________
B) TITULAÇÃO DE Fe(II) COM KMnO
4 CALCULADO:Equilibrar a equação : Fe2+ + MnO4- + H+ ------> Fe3+ + Mn2+ + H2O
Ensaio 1 Ensaio 2
Volume de KMnO
4 utilizado ___________ ___________Moles de Fe(II) determinados (nFe(II)) ___________ ____________
C) ESTEQUIOMETRIA DA REAÇÃO Fe(III) - cloreto de hidroxilamônio:
Equação : a Fe3+ + b NH3OH+ ------> a Fe2+ + ?
moles de cloreto de hidroxilamônio utilizados, (n(NH3OH)Cl) ______________
moles de Fe(III) que reagiram com o (NH3OH)Cl , (nFe(III)) ______________
relação estequiométrica experimental (nFe(III)) / (nNH3
OHCl) _______________CONCLUSÕES:
1) Qual é o estado de oxidação do nitrogênio no produto da reação ?
2) Escrever a fórmula da espécie nitrogenada obtida:
3) Escrever a equação completa balanceada e dar os valores numéricos dos coeficientes a e b.
Marque Verdadeiro ou Falso.
1) Na prática deve-se conhecer exatamente:
a) A molaridade do KMnO
4 0.2M (inicial).b) O número de moles de NH
3OHCl utilizados (nNH3OHCl ), por ser tratar de reagente limitante.c) O número de moles de Fe(III) iniciais.
2) Na reação de Fe(III) com NH
3OHCl:a) A relação estequiométrica experimental n
Fe(III) / nNH3OHCl é igual ab) A relação entre o n
KMnO4 utilizado para titular o Fe(II) e nNH3OHCl é de
TABELA DE RESPOSTAS
Fazer um círculo em torno das respostas corretas
1 |
a |
V |
F |
b |
V |
F |
|
c |
V |
F |
|
2 |
a |
V |
F |
b |
V |
F |
Trabalho Prático Nº2
Título: Identificação de substâncias orgânicas desconhecidas
Parte I
Cinco tubos contendo substâncias diferentes perderam seus rótulos. Sabe-se que os possíveis compostos são os seguintes:
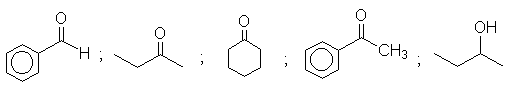
Únicamente por meio dos ensaios enumerados a seguir : Iodoformo, Tollens, Lucas, 2,4-dinitrofenilhidracina, identifique as substâncias que se encontram em cada tubo, rotulados agora como A, B, C, D e E. Utilize a mínima quantidade de ensaios possíveis, de forma a permitir a identificação clara de três dos compostos. Diferencie aqueles que não puderam ser identificados, utilizando-se da síntese de um de seus derivados.
Técnica experimental dos diferentes ensaios
Teste 1: iodoformo
Em um tubo de ensaios pequeno colocar 1mL de água, seis gotas do composto desconhecido e 20 gotas de uma solução de iodo-iodeto de potássio (reagente de iodoformo). Acrescentar gotas de solução de NaOH 10% até que a coloração escura do iodo passe a amarelo claro.
Agitar e esperar 2 min.Uma turbidez ou um precipitado amarelo indica que o teste é positivo.
Teste 2: reagente de Tollens
Reagente: em um tubo de ensaio pequeno bem limpo colocar 20 gotas de solução de nitrato de prata 5% e acrescentar 2 gotas de solução de NaOH 5%.
Agitar o tubo e acrescentar, gota a gota, solução de hidróxido de amônio 2N até dissolver novamente o precipitado.
Ao reagente recém preparado acrescentar uma gota de substância desconhecida. Agitar e deixar repousar durante 3 min. A formação de um espelho de prata indica que o teste é positivo.
Teste 3: 2,4-dinitrofenilhidracina (Teste similar ao da hidroxilamina)
A 4 gotas da amostra juntar 10 gotas de etanol e 10 gotas do reagente, agitar vigorosamente e deixar repousar por 10 minutos. O aparecimento de um precipitado amarelo/alaranjado indica um resultado positivo.
Teste 4: Lucas
Em um tubo limpo colocar 10 gotas da substância desconhecida e 25 gotas do reagente, misturar e deixar repousar o tubo de 15 a 20 minutos a temperatura ambiente. O aparecimento de uma turbidez indica que o teste é positivo.
Parte II
Escreva a reação genérica balanceada dos testes de reconhecimento realizados na parte I.
Parte III
Para diferenciar aqueles compostos que não puderam ser identificados pelas reações nos tubos de ensaios na parte I, sintetize a semicarbazona com semicarbazida. Esta síntese é utilizada habitualmente para identificar aldeídos e cetonas.
Para diferençar os dois compostos, basta sintetizar apenas um dos derivados .
Técnica de preparação do derivado:
Colocar 0,5mL do composto carbonílico em um tubo de ensaio de 25x150 e acrescentar 2mL de etanol e 5mL de água. Adicionar 500mg de clorohidrato de semicarbazida e 750mg de acetato de sódio. Aquecer a 70ºC durante 15 minutos. Esfriar, filtrar e lavar os cristais com poucas gotas de água fria. Recristalizar com etanol ou água, secar os cristais, anotar o ponto de fusão. Entregar o resto, devidamente rotulado, ao coordenador no final da prática.
DADOS DE TABELAS:
PM densidade
Pf da semicarbazonaBenzaldeído 106,13 1,0415 222ºC
Acetofenona 120,16 1,0281 198ºC
2-butanona 72,12 0,8054 146ºC
Ciclohexanona 98,15 0,9478 166ºC
RELATÓRIO DO TRABALHO PRÁTICO Nº 2
Parte I
Para cada tubo,
i) Marque com uma cruz (+) se o resultado do ensaio no tubo correspondente foi positivo; com um sinal de menos (-) se foi negativo, e com um círculo quando não houve necessidade de realizar o ensaio.
Iodoformo |
Tollens |
Lucas |
2,4-dinitrofenilhidracina |
|
Tubo A |
||||
Tubo B |
||||
Tubo C |
||||
Tubo D |
||||
Tubo E |
ii) Escreva as fórmulas das amostras que puderam ser identificadas com seus respectivos tubos de ensaio :
| Tubo: | Tubo: |
Tubo: |
|||
|
. |
. |
. |
iii) Escreva as fórmulas das amostras que não foram identificadas
|
. |
. |
Parte II
Escreva as equações correspondentes
Parte III
A amostra utilizada para preparar o derivado corresponde ao tubo ..........
Pf do derivado recristalizado:..............ºC
OS PONTOS DE FUSÃO SERÃO VERIFICADOS PELA EQUIPE DOCENTE
Coloque no quadro correspondente a fórmula da substância identificada em cada tubo.
| Tubo: | Tubo: | |||
|
. |
. |
Resolução e Pontuação dos Problemas Teóricos
Problema N° 1:
a) fórmula química de duas especies que contêm oxigenio no estado de oxidacao -2 e que participa neste processo.
Al2O3; AlO2-n ___________________ (1 ponto)
CO2 ___________________ (1 ponto)
b) a reacao no anodo é: (1 ponto)
C + 2O= = CO2 + 4e
a reacao no catodo é: (1 ponto)
Al2O3 + 6e = 2Al + 3O=
c) Sao requeridos 1.9kg de alumina (2 pontos)
cálculos realizados:
por cada mol de alumina sao obtidos dois mols de Al
Ar Al = 27
Mr Al2O3 = 102
para obter 1kg de Al sao requeridos (1kg x 102/54) = 1.889kg = 1.9kg
d) Obtem-se 1 kg de aluminio operando com a máxima corrente em __39.2__ minutos.
(2 pontos)
cálculos realizados:
1 mol Al requer 3F
Q = i.t = (1000/27).3.96500C.(100/35)
t = Q/i = 2356 seg = 39.2min
e) A massa inicial do anodo de grafite deve ser maior que ___441______g (1 ponto)
-0.5 pontos (reacao ao CO)
cálculos realizados:
reacao global: 2Al2O3 + 3C = 4Al + 3CO2
logo, se requer 3x12g de grafite por cada 2x102g de alumina
massa de grafite = 2500g.(36/204) = 441,3g = 441g
f) Envolver com um circulo a resposta correta:
SIM NAO justificativa: (2 pontos)
de acordo com os potenciais de reducao, em uma solucao aquosa ácida haveria desprendimento de H2 quando a concentracao de ions Al+3 for muito alta.
g) O equilibrio de solubilidade do hidróxido de aluminio Al(OH)3 é,
em solucoes ácidas: Al(OH)3(s) + 3H+(aq) = Al+3(aq) + H2O (1 ponto)
em solucoes básicas: Al(OH)3 (s) + OH- = AlO2- + 2H2O = Al(OH)4- (1 ponto)
h) Há maior concentracao de especies dissolvidas que contenham aluminio em uma solucao de pH = 1 (2 pontos)
justificativa:
porque K = [Al+3] / [H+]3 = 1 / [ 2x1032. Kw3] com o qual o pH = 1, [Al+3] = 5x106 M
enquanto que o pH =13,
K = 40 = [AlO2-] / [OH] com o qual, [AlO2-] = 4 M
Problema N° 2:
a) estrutura do isomero: ![]() (1
ponto)
(1
ponto)
b) equacao química: (1 ponto)
SF4 + F2 = SF6
equacao química: (1 ponto)
2SF4 + F2 = S2F10
c) A pressao parcial de SF4 é: ___30_ Torr. (1 ponto)
A pressao parcial de SF6 é: ___50_ Torr (1 ponto)
A pressao parcial de S2F10 é:__10 _Torr (1 ponto)
cálculos realizados:
D
Pt = DPSF4 + DPF2 + DPSF6 + DPS2F10a) SF4 + F2 = SF6
b) 2SF4 + F2 = S4F10
segundo a equacao (a): DPSF6 = -DPSF4a = -DPF2a
segundo a equacao (b): DPS2F10 = -(1/2)DPSF4b = -DPF2b
D
PSF4 = DPSF4a + DPSF4bD
PF2 = DPF2a + DPF2b = -60 Torr = (1/2)DPSF4b + DPSF4a (1)D
PT = DPSF4a + DPSF4b = -70 Torr (2)D
PSF4 = -70 Torr, portanto, PSF4 = 30 Torrdas equacoes (1) e (2) resulta,
-10 Torr = (1/2)DPSF4b = -DPS2F10 = -PS2F10
-DPSF4a = 50 Torr = PSF6
d) Reacao de hidrólise do hexafluoruro de enxofre: D G° = -221,3 kJ/mol (2 pontos)
-0.5 pontos por excesso ou erro nos algarismos significativos
cálculos realizados
SF6+ 3H2O = SO3 + 6HF
D
G = DH - TDSD
G0SF6 = DH0SF6 + TDS0SF6 = -89,6 kJ/mol - 298,2K x 441,7 J/Kmol = -221,3 kJ/mole) Envolver com um círculo a resposta correta.
A estabilidade do SF6 é termodinâmica cinética
justificativa: (1 ponto)
é cinética porque DG0 < 0 o qual indica que a reacao é espontânea.
f) Nao existem os compostos homólogos do hexafluoruro de enxôfre com cloro, com bromo ou com iodo porque Cl, Br, I sao átomos grandes e, portanto, há maior repulsao entre eles. (2 pontos)
Problema N° 3:
1. 1,2-dicloro-1,2-difeniletano (1 ponto)
2. (2 pontos)

| carbono | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| hibridacao | sp2 | sp2 | sp2 | sp2 | sp2 | sp2 | sp3 | sp3 | sp2 | sp2 | sp2 | sp2 | sp2 | sp2 |
Nota : utilizou-se uma numeracao arbitrária para facilitar a identificacao
3. (2 pontos)
Carbonos 1, 2, 3, 4, 5, 6 e 7 e os hidrogenios unidos a esse anel benzenico encontram-se em um mesmo plano.
Carbonos 8, 9, 10, 11, 12, 13 e 14 junto com os hidrogenios unidos a esse anel benzenico encontram-se em um mesmo plano.
Nota : utilizou-se a mesma numeracao indicada na resolucao do item anterior.
4. (2 pontos)
Justificativa: o benzeno pode ser representado como um híbrido de resonancia entre duas estruturas extremas de igual energia, nas quais os átomos de carbono unidos por ligacoes simples em uma delas, se encontram unidos por ligacoes duplas na outra e vice-versa. Como ambas contribuem em igual proporcao para a estrutura real do benzeno, as ligacoes carbono-carbono sao todas de mesmo comprimento e de um valor intermediario entre simples e dupla.
As estruturas ressonantes para o benzeno sao mostradas abaixo.

5. (4 pontos)
Justificativa: a menor distancia na ligacao carbono-cloro para o clorobenzeno deve-se a duas causas: 1°. o carbono ligado neste caso é sp2; tendo este orbital maior caracter s que no caso de ser um carbono sp3, os eletrons encontram-se mais perto do núcleo e, portanto, o comprimento da ligacao é menor. Isto explica, por exemplo, que a distancia C-CH3 no tolueno é menor que no etano. 2°. os eletrones nao compartilhados pelo cloro entram em ressonancia com o anel benzenico, gerando estruturas com dupla ligacao carbono-cloro. Como estas estruturas sao de maior energia devido apresentar cargas distintas, sua contribucao para a estrutura real do clorobenzeno é menor e, portanto, a ligacao carbono-cloro tem somente 16% de caráter de dupla ligacao. Abaixo sao mostradas as estruturas de resonancia correspondentes

6. (13 pontos)

A B C
(2 pontos por cada estrutura)
Atividade óptica: (1 ponto por cada estrutura)
A: NAO B: SIM C: SIM
Justificativa: (1 ponto)
O composto A apresenta um plano de simetria; é um composto meso.
Relacao estereoisomérica: (1 ponto por cada relacao)
A - B : diasteromeros
A - C : diasteromeros
B - C : enantiomeros
7. (12 pontos)

A B C D
i : alternadas : A y B (4 pontos)
ii : eclipsadas : C y D (4 pontos)
iii : conformacao de maior energia : D (2 pontos)
iv : conformacao de menor energia : A (2 pontos)
8. (4 pontos)
O isomero com menor momento dipolar é o composto meso, indicado com a letra A no ítem 6. Pode-se ver quando se desenha as conformacoes de menor energia para cada um dos tres estereoisomeros, que no caso do composto meso é a indicada como A no ítem 7, nela os cloros encontram-se localizados em posicao anti, pela qual os momentos dipolares de cada ligacao carbono-cloro anulam-se entre si. Isto nao ocorre com os outros estereoisomeros; daí podemos deduzir que o estreoisomero meso é o único cujo momento dipolar molecular é menor que o momento dipolar de cada uma das ligacoes carbono-cloro individuais.
Nota: O presente problema contempla o conhecimiento dos seguintes temas: nomenclatura, comprimento de ligacao, momentos dipolares, aromaticidade, representacao de moléculas no papel, estereoisomeria e conformacao nas moléculas acíclicas. Alguns dados necessários para a resolución do problema pode ser encontrados no final do texto.
Problema N° 4:
a) A ordem de reacao com respeito ao ácido salicílico é ___0____ (3 pontos)
cálculos realizados:
A = e.C.l
para ordem zero, v = -(dC/dt) = (-10/el).(dA/dt) = k
para ordem 1: v = -(dC/dt) = (-10/el).(dA/dt) = k.C
da tabela, para todo par de valores, DA/Dt = cte = 2,27.10-3 min-1
b) a concentración de ácido salicílico na solucao quando esta amostra é mantida sob iluminacao durante 30 minutos é _5,34.10-4____M. (2 pontos)
cálculos realizados:
(-10/el).(dA/dt) = k = (Co/Ao).2,27.10-3 min-1 = 6,34.10-6 M.min-1
C(t) = Co-kt
C(30min) = 7,24.10-4 M - 6,34.10-6 M.min-1.30min = 5,34.10-4M.
c) oxida-se: o ácido salicílico (1 ponto)
reduz-se: o oxígenio (1 ponto)
d) A concentracao de ácido salicílico em solucao é 6,73.10-4 M (4 pontos)
cálculos realizados:
v no ar = (1/5) v no oxigenio = 0,2.k
C = Co -(k/5).t = 7,24.10-4 M - 0,2.6,34.10-6 M.min-1.40min = 6,73.10-4M.
Problema N° 5:
a) O [CO3-2] a 37°C é: 2.9 x 10-5 M (1 ponto)
cálculos realizados:
[CO3-2] = Ka2 [HCO3-]/[H+] = 4,78.10-11 x 24.10-3 / 3,98x108 = 2,9x10-5M
A pressao parcial de CO2 no equilibrio com o sangue a 37°C é 0.083atm (1 ponto)
cálculos realizados:
[CO2(aq)] = [HCO3-].[H+] / Ka1 = = 3,98.10-8 .24.10-3 / 4,17. 10-7 = 2,3.10-3 M
Xco2 = [CO2(aq)] / [H2O] = 2,3.10-3 M / 55.55M = 4,14.10-5
Pco2 = kH.Xco2 = 2000atm. 4,14.10-5 = 0.083 atm
b)
especie |
concentracao/M | |
| H3PO4 | 2,0.10-9 | (0.5 ponto) |
| H2PO4- | 3,9.10-4 | (1 ponto) |
| HPO4= | 6,1.10-4 | (1 ponto) |
| PO4-3 | 3,3.10-9 | (0.5 ponto) |
cálculos realizados:
fósforo total = [H2PO4-] + [HPO4=] = 1,0.10-3 M
para este pH desprezam-se as concentracoes de H3PO4 e de PO4-3
Ka2/[H+] = [HPO4=] / [H2PO4-] = 1,55 (1)
[H2PO4-] + 1,55[H2PO4-] = 1,0.10-3 M (2)
de (2), [H2PO4-] = 3,9.10-4 M (3)
de (1) e (3), [HPO4=] = 6,1.10-4 M
[H3PO4] = [H+][H2PO4-]/Ka1= 2,0.10-9 M
[PO4-3] = Ka3.[HPO4=] / [H+] = 3,3.10-9 M
c)
solucao |
D pH |
|
(i) |
-0,05 | (1 ponto) |
(ii) |
-0,36 | (1 ponto) |
cálculos realizados:
i) pHi = pKa1 + log [[HCO3-] / [CO2(aq)]] = 6,38 + log (24/2) = 7,46
pHf = pKa1 + log [(24.10-3 - 0,2.10-3 ) / (2.10-3 + 0,2.10-3)] = 7,41
ii) pHi = pKa2 + log [[HPO4=] / [H2PO4-]] = 7,21 + log (0,64/0,36) = 7,46
pHf = pKa2 + log [(0,64.10-3 - 0,2.10-3 ) / (0,36.10-3 + 0,2.10-3] = 7,10
nestas condicoes a solucao ___(i)__ tem maior poder regulador (1 ponto)
Problema N° 6:
1. (3 pontos): A: CH3CH2CH=C(CH3)CH2CH2Cl (1 ponto)
B: CH3CHClCH=C(CH3)CH2CH3 (1 ponto)
C: (CH3)2CHCH=C(CH3)CH2Cl (1 ponto)
2. (1 ponto) A identidade de A, B y C nao é única já que os tres compostos apresentam isomería E/Z. Quaisquer isomeros dá os mesmos produtos.
3. (3 pontos): CH3CHClCO2H > CH3CH2CO2H > (CH3)2CHCO2H
4. (2 pontos) Pode-se justificar a acidez com base nos efeitos indutivos dos substituintes sobre o carbono a na carboxila. Ao se formar o ion carboxilato, um sustituinte que atrai eletrons ajudará a dispersar a carga negativa gerada (grupo Cl) e estabiliza o ion carboxila frente ao ácido carboxílico. Em compensacao, um sustituiente doador de eletrons aumenta a carga, desestabiliza o ion carboxilato e, portanto, diminui a força ácida (grupo CH3).
5. (2 pontos): D: ácido benzóico (PhCO2H) (1 ponto)
E: propanona (acetona) (CH3COCH3) (1 ponto)
6. (1 ponto) O reagente utilizado na segunda etapa da ozonólise é H2O2.
7. (2 pontos): F: cloreto de benzoila (PhCOCl) (1 ponto)
G: anilina (PhNH2) (1 ponto)
8. (1 ponto) A bromacao é uma reacao de substituicao eletrofílica aromática, portanto ocorrerá preferencialmente em um anel ativado por substituintes doadores de eletrons, como é o caso do grupo -NHR.
9. (4 pontos) A posicao preferida é a para, frente a orto, por impedimento estérico:
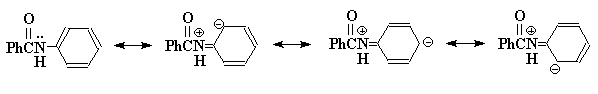
10. (2 pontos): H: PhCH2CBr(CH3)2 (1 ponto)
I: PhCHBrCH(CH3)2 (1 ponto)
11. (1 ponto) A adicao de HBr, na obscuridade, produz-se por um mecanismo ionico e segue a regra de Markovnikoff. Em compensacao, na presenca de peróxido, transcorre atraves de um mecanismo radicalar e a adicao é anti-Markovnikoff.
Este problema está basado nos seguintes temas: isomeria cis-trans em alcenos; produtos de adicao de HBr a alcenos e regra de Markovnikoff; deslocalizacao eletronica e estabilizacao por resonancia de arenos; efeitos do primeiro substituinte na reatividade de arenos frente a substitucao; efeito indutivo e força de ácidos carboxílicos; preparacao de cloretos de ácido a partir de ácidos carboxílicos e de amidas a partir de cloretos de ácido.
Resolução e Pontuação dos Problemas Práticos
Respostas doTRABALHO PRÁTICO Nº 1
PARTE A (4,5 pontos)
Equilíbrio da equação: 1,0 pontos
2 MnO4- + 5 C2O4= + 16 H+ ® 2 Mn2+ + 10 CO2 + 8 H2O
Volume adequado de oxalato de sódio: (13 - 15 mL) : 0,5 pontos
Molaridade do permanganato de potássio : 3 pontos no total
erro em algarismos significativos (x,xx.10-2M) : - 0,5 pontos
diferença porcentual no segundo resultado : 0 - 1%: - 1 - 2%: - 1,5 pontos >2%: - 3 pontos
PARTE B (7 pontos)
Equilíbrio da equação : 1 ponto
5 Fe2+ + MnO4- + 8 H+ ® 5 Fe3+ + Mn2+ + 4 H2O
Volume de permanganato de potássio : 3 pontos no total
erro em algarismos significativos (x,xx mL): - 0,5 pontos
diferença porcentual no segundo resultado: 0 - 1%: - 1 - 2%: - 1,5 pontos >2 %: - 3 pontos.
Número de moles de Fe(II) (1,40.10-3 moles): 3 pontos no total
erro em algarismos significativos (x,xx .10-3 moles) : - 0,5 pontos.
diferença porcentual no resultado teórico: 0 - 1%: - 1 - 2%: - 1 ponto 2 - 3%: - 2 pontos >3%: - 3 pontos
PARTE C (1,0 ponto)
Moles de cloreto de hidroxilamônio (7,00.10-4 moles): 0,5 pontos
erro em algarismos significativos: - 0,5 pontos
Moles de Fe(III) que reagiram (1,40.10-4 moles): 0,5 pontos
erro em algarismos significativos: - 0,5 pontos
CONCLUSÕES : 7,5 pontos
Tabela: 1a: F (1 ponto) 1b: V (0,5 pontos) 1c: F (0,5 pontos) 2a: V (1 ponto) 2b: F (1 ponto)
Estado de oxidação: 1 (1 ponto)
Identidade da espécie nitrogenada: N2O (1 ponto)
Equação completa e balanceada : (1,5 pontos)
4 Fe3+ + 2 NH3OH+ -----> 4 Fe2+ + N2O + H2O + 6H+
Respostas do
Trabalho Prático N° 2
Parte I ( 20 PONTOS)
i) Marque com uma cruz (+) se o resultado do ensaio correspondente a um dado tubo deu positivo e com um traço (-) se foi negativo. (10 PONTOS)
Iodoformo |
Tollens |
Lucas |
2,4-dinitrofenilhidrazona |
|
Benzaldeído |
- |
+ |
- |
+ |
2-butanona |
+ |
- |
- |
+ |
ciclohexanona |
- |
- |
- |
+ |
Acetofenona |
+ |
- |
- |
+ |
2-butanol |
+ |
- |
+ |
- |
4 ensaios: -2 pontos > 11 ensaios: -1 ponto ½ ponto por cada ponto mal informado
ii) Indique as amostras que puderam ser identificadas. (6 PONTOS)
|
|
|
iii) Indique as amostras que não puderam ser identificadas. (4 PONTOS)
|
|
(amostra 1) (amostra 2)
Parte II (6 PONTOS)
Escreva as equações correspondentes
REACAO DE TOLLENS
 (1,5 PONTOS)
(1,5 PONTOS)
TEST DE IODOFORMO
O resultado positivo do ensaio é devido a precipitação de CHI
3, sólido amarelo, (1,5 PONTOS)
(1,5 PONTOS)
TESTE DE LUCAS
 (1,5
PONTOS)
(1,5
PONTOS)
TEST DE 2,4-DINITROFENILHIDRAZONA
 (1,5 PONTOS)
(1,5 PONTOS)
( 1 ponto sem balancear)
Parte III
i) Se o composto utilizado para realizar o derivado corresponde a amostra 1, o Pf do derivado obtido é de 146 ºC. Se o composto utilizado para realizar o derivado corresponde a amostra 2, o Pf do derivado obtido é de 198 ºC (10 PONTOS)
ii) Coloque no quadro correspondente a fórmula da sustância identificada em cada tubo. (4 PONTOS)
| Tubo: amostra 1 | Tubo: amostra 2 | |||
|
|
Não entregando o derivado = -5 pontos
mal informada = -2 pontos
PONTUACAO TOTAL: 40 PONTOS