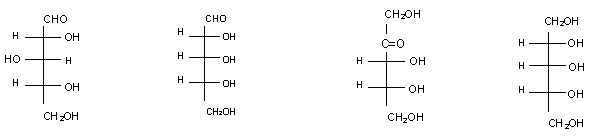
Caracas, outubro 2000
Prova Teórica
Outubro 15 a 21/10/00 Caracas VENEZUELA
RECOMENDAÇÕES
- Use somente a caneta esferográfica fornecida. - Não é permitido o uso de calculadoras programáveis. Escreva neste espaço a marca e o tipo de calculadora que usa neste exame: ____________ - Escreva o seu nome e o seu código pessoal de identificação no canto superior das primeiras páginas de cada uma das folhas de respostas. - Você dispõe de 5 horas para responder a todas as perguntas e completar a folha de respostas. Após ser dada a ordem de PARE, o trabalho deve ser concluído. Serão concedidos 3 (três) minutos para finalizar a solução da pergunta que estiver resolvendo. Caso não cumpra esta recomendação, receberá nota ZERO na referida pergunta. - Por favor, leia, cuidadosamente, o texto de cada uma das perguntas antes de iniciar. - Todos os resultados devem ser escritos nos espaços das folhas de respostas. Tudo aquilo que estiver escrito fora dos referidos espaços não será considerado. Não escreva nada na parte de trás da folha de respostas. Se houver necessidade de mais folhas de respostas para continuar a sua resolução, ou para substituir alguma das folhas utilizadas, solicite-as ao supervisor. - Quando concluir o exame, você deverá colocar todas as folhas no envelope fornecido, em seguida, entregue o envelope ao supervisor. Assine o recibo de entrega e guarde a cópia. Somente serão consideradas para correção as folhas entregues dentro do envelope. - Não abandone a sala em que se realiza o exame antes que alguém o autorize. - Este exame é composto de 6 (seis) perguntas e um total de 25 páginas, incluindo as folhas de respostas.NOTA: Neste exame deve ser utilizada a notação de vírgulas no lugar de pontos para a separação da parte decimal.
Problema Nº 1
Um professor de Química deseja comprovar que os seus estudantes compreenderam os temas de estrutura atômica, tabela periódica, propriedades periódicas e ligação química. Para isto, considerou três elementos A, D e E, cujos números atômicos, (Z) são:
Z(A) = 9; Z(D) = 19; Z(E) = 351. Escreva a configuração eletrónica para A, D e E nos seus respectivos estados fundamentais. Tabela 1 das folhas de respostas.
2. O professor divide o curso em três grupos e pede para estabelecerem em função da configuração eletrônica de cada elemento, o grupo G, e o período P ao qual pertencem. Indique nome e símbolo de A, D e E. Tabela 2 da folha de respostas.
Para justificar as suas respostas, cada grupo de estudantes as complementou com as seguintes afirmações:
Grupo 1. O elemento D pertence aos alcalinos e os elementos A e E pertencem aos halogênios.
Grupo 2. Por que a configuração eletrônica do elemento D tem número quântico principal n = 4 e apenas um elétron na sua camada de valência; enquanto que os elementos A e E têm 7 elétrons na sua camada externa e possuem número quântico principal n = 2 e 4, respectivamente.
Grupo 3. Por que o elemento D tem um elétron em um orbital s, enquanto que os elementos A e E, têm 5 elétrons nos orbitais p.
Selecione a afirmação que, sendo correta, justifica plenamente a resposta.
3. Escreva até um máximo de 8 combinações possíveis, com estes três elementos, (formada por átomos iguais ou diferentes). Classifique-os de acordo com a natureza da ligação química. Tabela 3 da folha de respostas.
4. Dados os raios iônicos de A, D e E, calcule a relação, raio do cátion / raio do ânion (r+/r-) dos compostos iônicos.Elemento |
Raio iônico |
A |
136 nm |
D |
133 nm |
E |
195 nm |
De acordo com os resultados obtidos e com a tabela a seguir:
Relações entre os raios e os números de coordenação:
| Relações entre os raios | Números de coordenação |
Geometria |
0,225 £ r+ / r- < 0,414 |
4 |
Tetraédrica |
0,414 £ r+ / r- < 0,736 |
6 |
Octaédrica (NaCl) |
0,736 £ r+ / r- < 1,000 |
8 |
Cúbica (CsCl) |
Os três grupos de estudantes fizeram as seguintes afirmações:
Grupo 1: Considere que todos os compostos possíveis têm a mesma solubilidade em água, já que têm o mesmo número de coordenação 6 e a mesma estrutura cristalina, pois possuem a mesma relação cátion / ânion e que se encontra na faixa:
- 0,414 £ r+ / r- < 0,736
Grupo 2: Considere que todos os compostos possíveis têm a mesma solubilidade em água, já que o número de coordenação 8 é igual para todos os compostos, uma vez que a relação cátion / ânion, se encontra na faixa:
0,736
£ r+ / r- < 1,000 Grupo 3: Considere que devido não ter a mesma relação r+ / r - encontramos diferentes tipos de coordenação. Isto faz com que não apresentem nem geometria, nem solubilidade em água iguais.
Selecione a afirmação correta.
5. Para as moléculas covalentes, cujo número total de átomos é 2, 4 e 6, complete na Tabela 4, da folha de respostas:
a. a estrutura de Lewis, indicando o número de ligações simples, número de ligações múltiplas e pares de elétrons livres no átomo central.
b. preveja a geometria molecular para cada caso.
c. como é a polaridade das ligações de cada uma das espécies químicas?
d. ordene, por ordem crescente de polaridade, as moléculas que apresentam ligações covalentes.
e. desenhe espacialmente as suas estruturas, indicando os ângulos de ligações e a hibridação do átomo central.
Problema Nº 2
Em cada uma das perguntas apresentadas a seguir, selecione a resposta correta:
1. A ribose (2,3,4,5-tetrahidroxipentanal) é um açúcar com 5 átomos de carbono, que se pode deduzir a partir da D-glicose eliminando-se o átomo de carbono 3. Qual é a estrutura da ribose em projeção Fischer?
a. b. c. d.
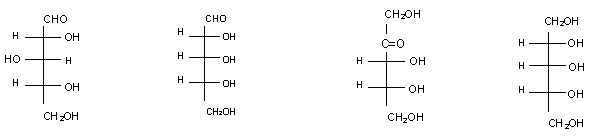
2. Para a ribose:
- a. Determine o número de estereoisômeros.
- b. Desenhe as estruturas de todos eles.
- c. Tendo em conta a configuração R ou S, dê os nomes da D-ribose e do seu enantiômero.
3. Na reação entre um aldeído e um álcool, se forma um hemiacetal e gera um novo átomo de carbono quiral. Qual é, de uma forma geral, a equação da reação que conduz aos hemiacetais?
- a. R’ - OH + R - CHO
R - CH2 - OR’
- b. R’ - OH + R - CHO
R’ - CH2 - OR
- c. R’ - OH + R - CHO
R - CHOH - OR’
- d. R’ - OH + R - CHO
R’ - CHOH - OR
4. A reação de formação de hemiacetal pode ocorrer dentro de uma mesma molécula de açúcar, uma vez que possui tanto grupos de álcool como de aldeído. Assim, são formados os ciclos nos açúcares. Tomando a ribose como exemplo e considerando todos os ciclos possíveis para ela, qual considera mais estável?
- a. o de três membros
- b. o de quatro membros
- c. o de cinco membros
- d. o de seis membros
A razão para escolher a resposta anterior é:
e. Porque o ângulo entre as ligações é de 90º , o qual é o mais estável, já que não apresenta tensão e, além disso, este ângulo tem um valor que está entre os ângulos de sp2 (60º) e sp3 (109º) f. Porque os ângulos coincidem com os da hibridação sp3 dos átomos do ciclo quando a molécula se flexiona e adquire a conformação "cadeira" deixando uma molécula sem tensão. g. Porque forma uma molécula plana, o que confere uma estabilidade especialmente alta ao ciclo pela coincidência entre o ângulo de um triângulo equilátero (60º) e o ângulo da hibridação sp2. h. Porque, com uma flexão, a molécula pode obter a conformação "envelope", o que permite um ciclo livre de tensão com ângulos que coincidem com a hibridação sp2 de todos os átomos que formam o ciclo.
5. Quando se forma o hemiacetal em um açúcar se tem duas possibilidades para a configuração absoluta no átomo de carbono 1:
a a que tem o OH para baixo e a b que tem o OH para cima (em projeção de Haworth). No caso da estrutura cíclica da D–ribose e considerando unicamente posições axiais e equatoriais, qual é a mais estável?a b. b c. As duas configurações têm igual estabilidadea.
6. Se olhamos a molécula da b-D-glucopiranosa ao longo da ligação entre os átomos de carbono 1 e 2 (com o 2 adiante), qual é a projeção de Newman correta para a conformação mais estável?
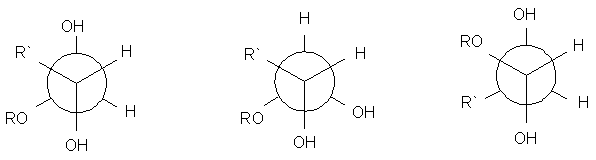
a. b. c.
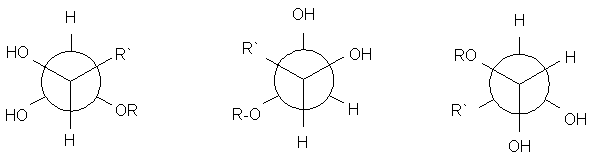
d. e. f.
Problema Nº 3
Lavagem
i) Hidrodessulfuração: Junta-se ao gás natural uma pequena quantidade de A, de forma que todos os sulfetos orgânicos são convertidos em D. Nesta etapa também se saturam as olefinas presentes no gás natural.
A + Sulfeto de carbonila (COS)
O composto D contido na corrente gasosa segue por leitos absorventes de óxido de zinco onde é transformado. D tem odor desagradável, é solúvel em água e, também, é produzido nas erupções vulcânicas.
D + óxido de zinco
F + Z (5)
O composto F fica retido no leito absorvente.
ii) Reformação: Este processo ocorre em dois reformadores.
Reformador primário. O gás dessulfurado, cujo principal componente é o metano, reage com Z em presença de um catalisador e calor.
- Cat / Calor
- Metano + Z
G + A (6)
- Cat / Calor
- Metano + Z
E + A (7)
- Cat / Calor
- G + Z
E + A (8)
Reformador secundário - topo. Na parte superior do reator (topo), o gás proveniente do reformador primário reage segundo as seguintes reações exotérmicas:
- A + X + M
Z + M (9)
- Metano + X + M
A + M + E (10)
- Metano + X + M
Z + M + E (11)
X: gás incolor, inodoro, associado com a vida.
Reformador secundário – catalisador. Na parte inferior do reator há um leito de catalisador onde ocorrem as seguintes reações endotérmicas:
- Metano + Z
G + A (12)
- G + Z
E + A (13)
iii) Conversão: O composto G, que não reagiu na etapa anterior, é transformado em E, o qual é eliminado, posteriormente, num processo de absorção.
iv) Lavagem e metanação: O sistema de MEA (monoetanol amina) consiste num processo contínuo em contracorrente gás/amina para purificar e recuperar E do gás do processo. A solução de amina é regenerada facilmente quando entra em ebulição a baixa pressão, liberando o E que contém.
Os resíduos de E e G são convertidos em metano, já que este é inerte em relação ao processo de formação do amoníaco no reator de síntese.
v) Compressão e síntese: O gás de síntese (basicamente A e M) para obtenção do amoníaco, é comprimido a uma pressão adequada. O amoníaco é produzido ao fazer reagir A e M de acordo com a seguinte reação exotérmica:
- FeCl3
- A + M
amoníaco (14)
- Qual será a pressão de operação mais adequada para obter uma maior conversão - uma pressão total de 300 atm ou de 700 atm?
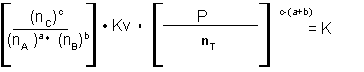
Se o gás de síntese entra nos reatores onde reagem A e M com uma composição de 75% mol de A/mol e 25% mol de M/mol, e supondo que a reação atinge o equilíbrio, calcule: a) a conversão e composição percentual da mistura que se forma nos reatores para as condições:
b. Qual das duas condições recomendaria para operar o reator de síntese de amoníaco?
Caminho de Síntese:
Determine dos caminhos anteriores: Qual é o que permite obter o composto com a estereoquímica desejada? (síntese estereoespecífica).
Problema Nº
51. a) Escreva as equações químicas balanceadas para as etapas (1-5), tenham ou não originado precipitado. Indique os estados de agregação de reagentes e produtos.
b) Identifique os cátions que precipitaram.
2. Realizou-se uma experiência adicional na qual, a um dado volume de água desmineralizada a 25° C, foi adicionado um excesso de cloreto do íon identificado no precipitado amarelo. A concentração do ion cloreto na solução foi medida em intervalos de tempo regulares. Os resultados são apresentados no seguinte gráfico:
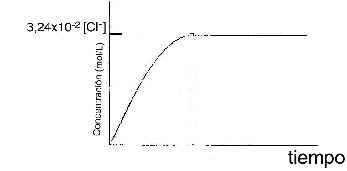
Escreva a equação balanceada do sal em equilíbrio e calcule o produto de solubilidade, a 25° C.
Problema Nº 6
Parte I
A cinética da hidrogenação de benzotiofeno (BT) a 2,3-dihidrobenzotiofeno (DHBT) (Eq. 1), utilizando como catalisador o complexo catiônico de ródio [Rh(COD)(PPh3)2]PF6, foi realizada, variando as concentrações de benzotiofeno, catalisador e hidrogênio, a diferentes temperaturas. Ao fazer o gráfico da concentração de DHBT em função do tempo foi possível determinar, com base no valor da inclinação da reta, as velocidades iniciais.

Na tabela 1 observam-se os dados obtidos experimentalmente.
vi = velocidade inicial.Tabela 1. Dados cinéticos para a hidrogenação de benzotiofeno na presença de um catalisador de ródio.
- [cat]
- (mol/L)
- [BT]
- (mol/L)
- [H2]
- (mol/L)
- T
- (oC)
- vi
- (mol.L-1 s-1)
- 5,5 x10-4
- 5,0 x10-2
- 2,3 x10-3
- 125
- 9,0 x10-7
- 6,0 x10-4
- 5,0 x10-2
- 2,3 x10-3
- 125
- 10,3 x10-7
- 6,5 x10-4
- 5,0 x10-2
- 2,3 x10-3
- 125
- 10,7 x10-7
- 8,0 x10-4
- 5,0 x10-2
- 2,3 x10-3
- 125
- 13,7 x10-7
- 6,0 x10-4
- 1,0 x10-2
- 2,3 x10-3
- 125
- 10,3 x10-7
- 6,0 x10-4
- 6,2 x10-2
- 2,3 x10-3
- 125
- 10,3 x10-7
- 6,0 x10-4
- 1,0 x10-2
- 2,3 x10-3
- 125
- 10,3 x10-7
- 6,0 x10-4
- 5,0 x10-2
- 2,0 x10-3
- 125
- 8,9 x10-7
- 6,0 x10-4
- 5,0 x10-2
- 2,7 x10-3
- 125
- 12,0 x10-7
- 6,0 x10-4
- 5,0 x10-2
- 3,0 x10-3
- 125
- 13,8 x10-7
- 6,0 x10-4
- 5,0 x10-2
- 2,3 x10-3
- 110
- 3,7 x10-7
- 6,0 x10-4
- 5,0 x10-2
- 2,3 x10-3
- 115
- 5,2 x10-7
- 6,0 x10-4
- 5,0 x10-2
- 2,3 x10-3
- 130
- 15,6 x10-7
Com estes dados, faça os gráficos logarítmicos necessários para determinar a ordem da reação em relação às concentrações de catalisador, benzotiofeno e hidrogênio; e estabeleça a Lei de Velocidade experimental para a reação estudada. (NOTA: As ordens de reação devem ser números inteiros).
Parte II
O efeito da temperatura sobre a velocidade da reação foi estudada no intervalo de 383 a 403 K para as concentrações de BT, catalisador e hidrogênio iguais a 5,0 x 10-2 mol.L-1, 6,0 x1 0-4 mol.L-1 e 2,3 x 10-3 mol.L-1, respectivamente. Estes dados se encontram na tabela 1.Com esta informação:
- 1) Calcule as constantes de velocidade nas diferentes temperaturas
- 2) Faça o gráfico correspondente, e
- 3) Calcule a energia de ativação, Ea em kJ/mol.
R = 8,31 J/(K. mol)
Exprimir os resultados em notação científica com dois decimais.
o o o o o o o o o
VI Olimpíada Ibero-americana de Química - 2000Exame de laboratório
Caracas, 19 de outubro de 2000
RECOMENDAÇÕES
- • Escreva o seu nome e o seu código pessoal de identificação, que se encontra na sua bancada, na parte superior de cada uma das folhas de resposta.
- • Por favor leia cuidadosamente o texto de cada uma das perguntas e planeje o trabalho experimental antes de começar.
- • A prova é constituída por dois problemas experimentais.
- • Cada problema consta de duas partes: Proposta de Procedimento Experimental (envelope 1) e Execução Experimental (envelope 2). O envelope N° 1 contém a Parte I (Proposta de Procedimento Experimental) de cada problema. Você tem 30 minutos para responder as perguntas do envelope 1. Quando se indicar que terminou o tempo, coloque os enunciados e as folhas de respostas dentro do envelope. Entregue-o ao supervisor para que assine o recibo imediatamente.
- • Você receberá o envelope N° 2 com a segunda parte da prova (Execuções Experimentais). Você tem 4 horas e 30 minutos para realizar toda a parte experimental. Deverá parar o trabalho depois que a ordem de PARE seja dada. Terá um prazo de 3 minutos para terminar o problema que estiver a completar. Se ultrapassar esse tempo terá uma pontuação de zero no dito problema.
- • Quando tiver terminado o exame, deverá colocar todas as folhas da Parte Experimental no envelope N° 2 que lhe foi dado e entregá-lo aos supervisores. Assine o recibo de entrega e guarde a cópia. Só serão avaliadas as folhas entregues dentro dos envelopes N° 1 e N° 2.
- • Todos os resultados devem ser escritos nos espaços das folhas de respostas. Tudo aquilo que for escrito fora dos ditos espaços não será avaliado. Não escreva nada na parte de trás das folhas de resposta. Se você precisar de mais papel para trabalhar ou para substituir alguma resposta nas folhas dadas para esse fim, solicite-a ao supervisor.
- • Não abandone o laboratório até que seja indicado que o pode fazer.
- • Você poderá solicitar a substituição de cada reagente e/ou material de laboratório esgotado ou danificado. O custo desta solicitação será de menos 1 ponto dos 20 que vale cada parte.
- • No final da prática coloque os resíduos químicos nos recipientes existentes para tal fim.
PROBLEMA EXPERIMENTAL N° 1
Cor, solubilidade e equilíbrio de íons complexos de Níquel (II) em solução aquosa.
• Preparar uma série de complexos de Ni(II) com os ligantes água, amoníaco (NH3), etilenodiamina (en), dimetilglioxima (dmg) e cianeto (CN-).
• Caracterizar os diferentes complexos de Ni(II) preparados com base nas suas observações.
PROPOSTA DE PROCEDIMENTO EXPERIMENTAL
Parte I
Utilizando os materiais e reagentes listados na Tabela 1, indique um procedimento experimental que lhe permita preparar e caraterizar (cor e formação ou ausência de precipitado) complexos de níquel (II) com os ligantes NH3, en, dmg e CN- .
Desenhe uma ou várias tabelas que lhe permitam mostrar os resultados a serem obtidos na experiência.
Tabela 1 - Materiais e reagentes a serem utilizados na preparação e caracterização dos complexos de Ni(II).
- Reagentes
- Materiais
- Água destilada
- Sulfato de Níquel (II) (1 mol/dm3 )
- Amoníaco (1 mol/dm3 )
- Etilenodiamina (1 mol/dm3 )
- Dimetilglioxima (1 mol/dm3 )
- Cianeto de Potássio (1 mol/dm3)
- Copo ou bequer de 50 e 100 cm3
- Vareta de vidro
- Pisseta (esguicho de água destilada)
- Pipetas graduadas
- Cilindros graduados (proveta) de 10 e 50 cm3
- Pipetas Pasteur (conta-gotas)
- Folha de papel branco
Parte II.
A seguir é indicado o procedimento que deve ser seguido para a preparação e caracterização dos diferentes complexos de Ni(II). Este procedimento não é necessariamente o mesmo que você propôs na parte I.
Objetivos:
• Preparar uma série de complexos de Ni(II) com os ligantes água, amoníaco (NH3), etilenodiamina (en), dimetilglioxima (dmg) e cianeto (CN-).
|
|
|
3 , com tampa, um ao lado do outro, etiquete-os e numere-os. • Adicione a cada frasco 15 cm3 de água destilada e 1 cm3 de sulfato de níquel(II) hexahidratado (1mol/dm3). Tampe e agite. • Ao frasco Nº 2 junte 2 cm3 de NH3 (5 mol/dm3). Tampe e agite. • Ao frasco Nº 3 adicione 0,75 cm3 de etilenodiamina a 25%. Tampe e agite. • Ao frasco Nº 4 adicione 1,25 cm3 de dimetilglioxima a 1%. Tampe e agite. • Ao frasco Nº 5 adicione 4 cm3 de cianeto de potássio (PRECAUÇÃO: é altamente tóxico, seja cuidadoso ao manipulá-lo ) 1mol/dm3. Tampe e agite.Procedimento Experimental A:
- • Coloque cinco (5) frascos de 20 cm
Observe e registre os seus resultados na Tabela 2 da Folha de respostas.
Procedimento Experimental B.
- Coloque 30 cm3 de água destilada num copo ou bequer de 150 cm3.
- Adicione 2 cm3 de sulfato de níquel hexahidratado 1mol/dm3 e agite-o.
- Adicione sucessivamente, agitando depois de cada adição, e conservando a ordem, 4 cm3 de amoníaco (5 mol/dm3); 2 cm3 de etilenodiamina a 25%; 2,5 cm3 de dimetilglioxima a 1% e 20 cm3 de cianeto de potássio 1 mol/dm3.
- Observe as mudanças e registre na Tabela 3 da Folha de respostas a cor que prevalece depois de cada adição. Indique, além disso, qual é o complexo mais estável.
Com base nos resultados obtidos e na informação fornecida:
- 1. Escreva as equações químicas balanceadas que representem a formação de cada complexo de acordo com o Procedimento Experimental A.
- 2. Escreva os nomes IUPAC para cada um dos complexos preparados.
- 3. Represente as estruturas geométricas de cada um dos complexos preparados.
- 4. Ordene os complexos de Ni(II) preparados de forma decrescente de estabilidade.
Parte III
A seguir deverá identificar um reagente desconhecido para detectar a presença de Ni(II) numa peça fornecida. Para identificar o reagente desconhecido siga o procedimento que considere mais adequado.
Para detectar a presença de níquel:
- Coloque a peça num vidro de relógio.
- Adicione sobre ela 1 ou 2 gotas de amoníaco (10%) e 1 ou 2 gotas do reagente desconhecido. Esfregue com um cotonete.
Com base nos resultados e na informação fornecida:
5. Identifique o reagente desconhecido.
6. Indique se a mostra contém níquel
Folha de respostas
Parte I
Proponha um procedimento experimental que lhe permita preparar e caracterizar complexos de níquel (II) com os ligantes NH3, en, dmg e CN-.
Parte II
Tabela 2.
Fórmula |
Cor |
Formação de Precipitado |
Geometría |
Kf (25 ºC) |
| [Ni(H2O)6] 2+ | Octaédrica |
-------- |
||
| [Ni(NH3)6]2+ | Octaédrica |
6,46 x108 |
||
| [Ni (en)3]2+ | Octaédrica |
3,31 x 1018 |
||
| [Ni(dmg)2] | Planar quadrada |
4,17 x 1017 |
||
| [Ni(CN)4]2- | Planar quadrada |
3,16 x 1030 |
Tabela 3. Indique as cores obtidas depois da adição de cada reagente no Procedimento B
| Reagentes | H2O + NiSO4 |
+ NH3 |
+ en |
+ dmg |
+ CN- |
| Cores |
Qual dos complexos obtidos é o mais estável? ______________________
Justificativa - marque com (x) a opção correta
- Força do ligante e geometría
- Força do ligante e constante de formação (Kf)
- Força do ligante e cor
- 1. Escreva as equações químicas balanceadas que representam a formação de cada complexo de acordo com o Procedimento Experimental A.
- 2. Escreva o nome IUPAC para cada um dos complexos preparados.
- 3. Represente as estruturas geométricas para cada um dos complexos
4. Ordene os complexos de Ni (II) de forma decrescente de estabilidade.
Parte III
5. Qual é o reagente que foi usado na identificação do níquel? __________
PROBLEMA EXPERIMENTAL N° 2
Esterificação da vanilina.
Os compostos podem ser:
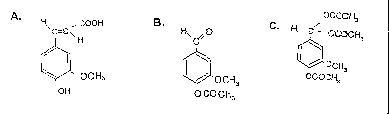
PARTE I - Proposta de um procedimento EXPERIMENTAL.
Deseja-se diferençar os três compostos A, B e C por meio da caracterização de grupos funcionais, realizando o menor número de experiências. Para elaboração de sua proposta, escolha da seguinte lista, os reagentes e materiais necessários.
Reagentes
Materiais
Elabore uma tabela com os reagentes selecionados e os resultados esperados, que justifiquem suas respostas.
PARTE II.
Procedimento Experimental
Reagentes
Materiais
Com os materiais e reagentes descritos anteriormente você realizará no laboratório uma síntese, seguindo o procedimento descrito a seguir:
PARTE II
Procedimento Experimental
1. Síntese
2. Recristalização
Solicite ao supervisor de sua área que pese a sacola etiquetada antes e logo depois de colocar o produto nela. Anote na folha de resposta (Tabela 1) a massa da bolsa vazia e a massa do produto recristalizado. Assegure-se que o supervisor assinou a folha de respostas.
TABELA DE PROPRIEDADES FÍSICAS
Solubilidade |
|||||||
| Composto | Fórmula | Massa molar (g/mol) | Temp. de fusão (°C) | Temp. de ebulição | Densidade (g/cm3) | H2O | Solúvel em |
| Vanilina | C8H8O3 | 152,15 | 77 - 79 | 285 | 1,056 | i | al, eth, bz, chl |
| Anídrido acético | (CH3CO)2O | 102,09 | - 73,1 | 139,9 | 1,0830 | s | al, eth, bz |
| Etanol | CH3CH2OH | 46,09 | - 117,3 | 78,5 | 0,7893 | s | al, bz |
| Produto de síntese | C10H10O4 | 194,19 | 64 - 65 | sublima | --- | i | al,eth, bz |
3. Provas de grupos funcionais
Registre na Tabela 2 da folha de respostas, como positivo (+) ou negativo (-), cada um dos resultados das seguintes provas:
2,4 dinitrofenilhidrazina: dissolva uma pequena porção do produto obtido em 1 mL de etanol e junte à solução 2 mL de 2,4-dinitrofenilhidrazina. Observe e registre seus resultados na Tabela 3 da folha de resposta.
Cloreto de hidroxilamina: à solução básica de cloreto de hidroxilamina junte 1mL de ácido clorídrico, duas gotas de cloreto de ferro III e pequena porção do produto. Observe e registre seus resultados na Tabela 3 da folha de resposta.
PARTE III - Resultados Experimentais.
- 1. Indique o tipo de reação que conduziu a formação do produto.
- 2. De acordo com os resultados experimentais desenhe a provável estrutura do produto.
Apêndice
Filtração mediante seringa.
Você dispõe de uma seringa de 25 mL com um orifício lateral.
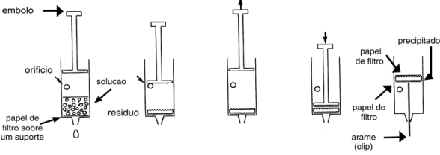
Fig. 1 Fig. 2 Fig. 3 Fig. 4 Fig. 5
- 1. Encha a seringa pela parte superior com a solução a filtrar. O nível do líquido deve estar abaixo do orifício. Coloque de novo o êmbolo. (Fig. 1)
- 2. Feche o orifício com o dedo e pressione o êmbolo para filtrar e pare antes de que alcance o orifício. (fig. 2)
- 3. Retire o dedo do orifício e mova o êmbolo para trás. (Fig. 3)
- 4. Repita os passos 2 e 3 várias vezes.
- 5. Remova o êmbolo e coloque outro papel de filtro sobre o resíduo. Coloque novamente o êmbolo e pressione sobre o resíduo. (Fig. 4)
- Retire o êmbolo e, com a ajuda do arame, empurre o papel de filtro com o sólido. (Fig. 5)