Exame aplicado em 11.09.99
QUESTÃO 1
PARTE I
Dois frascos (A e B), de mesmo volume, estão cheios de gás submetidos à mesma temperatura. O frasco A contém 0,32 g de oxigênio (O2) e o frasco B contém 0,68 g de um gás B, de fórmula molecular Z2Y. A pressão no frasco A é "x" e a pressão no frasco B é "2x".
PARTE II
A pressão parcial de oxigênio no ar, a 25o C, é de 158 mmHg, sendo a pressão total igual a 760 mmHg. O ar que é expirado do pulmão, após a respiração, apresenta uma pressão parcial de O2 de 115 mmHg, sob as mesmas condições. Quantos moles de O2 são absorvidos pelos pulmões a partir de um litro de ar ? (R= 0,082 L.atm/K.mol)QUESTÃO 2
A anilina, C6H5NH2, é uma base fraca, muito empregada na indústria de corantes. Seu ácido conjugado, cloridrato de anilina, [C6H5NH3]Cl, Ka = 2,4 x 10-5, pode ser facilmente titulado com uma base forte como NaOH. Considerando que você titulou 25,0 mL de uma solução de cloridrato de anilina 0,100 mol/L com uma solução de NaOH 0,115 mol/L, responda:"to Walter Kohn for his development of the density-functional theory and to John Pople for his development of computational methods in quantum chemistry"
QUESTÃO 3
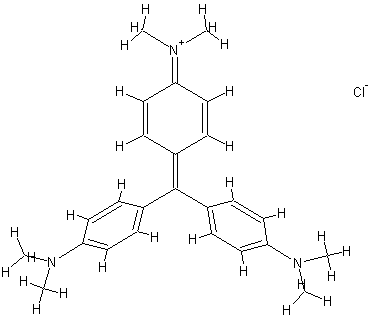
A violeta de genciana, também conhecida como cristal violeta, tem a seguinte fórmula estrutural
A geometria otimizada do cátion, utilizando o método computacional AM1, é obtida usando apenas os elétrons de valência de cada um dos elementos. Este método computacional fornece distância de ligação, ângulos, carga sobre os átomos e calor de formação.
QUESTÃO 4
Uma cela eletroquímica é construída a partir de uma meia-cela consistindo de um arame de prata imerso numa solução de AgNO3, e outra consistindo de um arame de platina em uma solução aquosa de Fe2+ e Fe3+.
QUESTÃO 5
PARTE I
Para cada um dos seguintes processos, indique e justifique o sinal algébrico de
deltaH0 , deltaS0 e deltaG0:a) A "quebra" da molécula de água líquida em hidrogênio e oxigênio gasosos, processo que requer considerável quantidade de energia.
b) A dissolução de pequena quantidade de NH4Cl em água. A solução torna-se bastante fria no processo.
c) A explosão de dinamite, uma mistura de nitroglicerina (C3H5N3O9) e terra diatomácea. Essa decomposição explosiva origina produtos gasosos, tais como água, CO2 e outros. Muito calor é liberado neste processo
d) A combustão de gasolina no motor de um carro, como exemplificado pela combustão do octano:
2 C8H18(g) + 25 O2(g) --> 16 CO2(g) + 18 H2O(g) + calorPARTE II
Hidrogênio gasoso pode ser produzido a partir da reação entre carvão e vapor d'água, como mostra a reação:C(s) + H2O(g) --> CO(g) + H2(g)
Dados (valores aproximados):
H2O(g) --> delta H0f = -241,8 kj/mol , deltaS0f = +188,8 j/k.mol e deltaG0f = -228,6 kj/mol (298,15K) CO(g) --> deltaH0f = -110,5 kj/mol , deltaS0f = +197,7 j/k.mol e deltaG0f = -137,2 kj/mol (298,15K)R = 8,31 J/K.mol
QUESTÃO 6
O atraente sexual da traça Pseudotsuga, foi sintetizado do modo indicado a seguir. Indique a estrutura e o nome do atraente sexual (F) e de todos os compostos intermediários (B, C, D e E):