III
Olimpíada Norte - Nordeste de QuímicaExame aplicado em 04.10.97
Problema
1Considere os seguintes dados experimentais, referentes à reação:
sulfeto de zinco + oxigênio ----> óxido de zinco + dióxido de enxofre.
Massas de Reagentes |
Massas de Produtos |
|||
Sulfeto de zinco |
Oxigênio |
Óxido de zinco |
Dióxido de enxofre |
|
| Antes da reação | 210,0 g |
96,0 g |
- |
- |
| Após a reação | 15,2 g |
- |
162,8 g |
128,0 g |
a) Que substância foi colocada em excesso?
b) Que massa de sulfeto de zinco reagiu?
c) Houve conservação da massa?
d) Quantos gramas de oxigênio seriam necessárias para reagir totalmente com 210,0 g de sulfeto de zinco?
e) Qual a razão entre as massas do sulfeto de zinco e oxigênio que reagiram?
f) Escreva a equação balanceada da reação.
Considere: M(O) = 16 g/mol; M(S) = 32 g/mol; M(Zn) = 65,4 g/mol
Problema
2O professor fornece ainda as seguintes informações:
Que teste você faria para poder etiquetar corretamente os frascos?
Problema
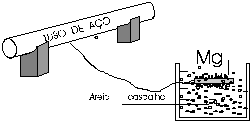
3Uma tubulação de aço pode ser protegida da corrosão atmosférica através da proteção catódica, que consiste em se instalar um bloco de metal mais reativo ligado à tubulação por um fio condutor.

a) classifique a reação que ocorre neste sistema.
b) que massa de magnésio é necessária para reagir com 100g de ferro oxidado Fe (II)?
c) qual o sentido (verdadeiro) da corrente de elétron?
d) que outros metais poderiam ser usados em substituição ao magnésio?
e) supondo que haja um consumo de 100g de magnésio por ano, qual o valor médio da corrente de elétrons?
Considere: M(Mg) = 24,3 g/mol; M(Fe) = 55,8 g/mol
1 ampère = 1C / s; 96.500 C = 1 mol de e-
Problema 4
Em um recipiente de 20 litros, mantém-se uma mistura dos gases SO
2 , SO3 e O2 a uma temperatura cuja constante de equilíbrio (kc) tem o valor de 280.a) escreva a equação que representa a reação química em equilíbrio.
b) escreva as expressões para as constantes de equilíbrio Kc e Kp.
c) se, nas condições até agora apresentadas (v = 20 L : Kc = 280 e T = 727 0C), existem no recipiente as seguintes quantidades: 50 mols de SO
2 , 150 mols de SO3 e 75 mols de O2, verifique se a mistura se encontra em equilíbrio. Justifique sua resposta.d) Caso as condições do item anterior (item c) mostrem que os gases na reação não estão em equilíbrio, que variações se devem introduzir nas quantidades das substâncias da reação para que se estabeleça o equilíbrio?
e) sabendo que a reação solicitada no item a é exotérmica, explique que alterações sofrerá o equilíbrio químico se:
I) a temperatura do sistema for diminuída.
II) o volume do recipiente for aumentado.
III) O
2 for adicionado ao sistema.IV) ocorrer uma redução da pressão.
Dados: M (O) = 16 g/mol e M(S) = 32 g/mol
Problema
5I) moléculas cujos átomos centrais possuem menos que 8 elétrons.
II) moléculas cujos átomos centrais possuem mais que 8 elétrons.
III) moléculas que contêm um número ímpar de elétrons.
a) Separe as moléculas polares das não-polares e explique cada caso: CH
2Cl2, H2O, CO2, C2 H4, BCl3 e CH2O.b) Disponha em ordem crescente de "comprimento de ligação" as espécies químicas: O
2, O2+ e O2-, e justifique sua resposta.c) Indique a geometria das moléculas e íons:
N
2O, OF2, H2O2, C2H2, ClO2- e NO2-Problema
6Escreva as fórmulas estruturais para os seguintes compostos:
a. metacresol
b. ácido ftálico
c. benzoato de benzila
d. acetofenona
e. benzaldeído
Usando as fórmulas estruturais dos itens de (a - e), complete as reações abaixo escrevendo as equações químicas completas para cada item com as respectivas fórmulas estruturais:
a. meta-cresol + NaOH --->
b. ácido ftálico + NaHCO
3 ---->c. benzoato de benzila + KOH ---->
d. acetofenona + HCN ---->;
e. benzaldeído + Ag(NH3)2OH / NaOH --->;
f. fenona + HCN --->;