VI
Olimpíada Norte - Nordeste de Química
e
Seletiva para a Olimpíada Ibero-americana de
Química - 2000
Exame aplicado em 27.05.2000
Somente as questões de números 1 a 6
serão consideradas na composição de notas da Prova da VI ONNeQ.
QUESTÃO 1
Dentre as propriedades periódicas dos elementos químicos, a energia (ou potencial) de
ionização, está estreitamente relacionada com a formação de cristais iônicos.
- defina o que é energia de ionização
- como esta propriedade varia na tabela periódica, ao longo dos grupos e dos períodos ?
- os valores das primeiras energias de ionização de Al, Ga e In são, respectivamente:
0,5776; 0,5788 e 0,5583 kJ/mol. Por que esses valores não seguem a tendência geral
descrita no item anterior ?
- que outras energias, além da energia de ionização, estão também envolvidas na
formação de um cristal iônico a partir de seus elementos no estado natural ?
- por que não existe um cristal com estequiometria NaCl2 ?
QUESTÃO 2
- Cloreto de sulfurila, SO2Cl2, se decompõe em fase gasosa,
produzindo SO2(g) e Cl2(g). A concentração do SO2Cl2,
foi acompanhada em uma experiência e verificou-se que o gráfico do ln (logarítmo) de
[SO2Cl2] contra o tempo é linear e que, em 240 segundos, a
concentração caiu de 0,400 mol/L para 0,280 mol/L.
- qual a constante de velocidade da reação SO2Cl2(g) ®
SO2(g) + Cl2(g) ?
- qual a meia-vida desta reação ?
- qual a diferença entre velocidade média e velocidade instantânea de uma reação ?
- comente dois exemplos - que podem ser observados no cotidiano - da influência da
temperatura na velocidade de uma reação.
QUESTÃO 3
Em um laboratório havia um frasco com uma amostra de ácido sulfúrico. Este frasco
estava com o rótulo deteriorado e, além do nome do produto, lia-se apenas sua densidade:
1,728 g/mL. 10 mL deste ácido foram diluídos para 500 mL e, uma alíquota de 25 mL foi
titulada com uma solução de hidróxido de sódio de concentração 27,28 g/L. Nesta
titulação foram gastos 20,23 mL do titulante. Pede-se:
- a concentração, em mol/L da amostra original de ácido sulfúrico;
- a porcentagem de ácido sulfúrico por peso dessa mesma amostra;
- o pH da solução ácida, após a diluição para 500 mL;
- o volume, desta mesma solução, necessário para a completa neutralização de 5,0 g de
uma amostra de MgO de título 85%.
A resposta numérica deve ser escrita com conveniente quantidade de algarismos
significativos.
QUESTÃO 4
- Na tabela seguinte figuram as entalpias-padrão e as energias livres de formação de
algumas substâncias iônicas cristalinas e em solução aquosa 1 m
(molal):
Substância |
D H° f (kJ/mol) |
D G° f (kJ/mol) |
AgNO3 (s) |
-124,4 |
-33,4 |
AgNO3 (aq., 1m) |
-101,7 |
-34,2 |
MgSO4 (s) |
-1283,7 |
-1169,6 |
MgSO4 (aq., 1m) |
-1374,8 |
-1198,4 |
- escreva a reação de formação do AgNO3(s). Com base nesta reação,
a entropia do sistema aumenta ou diminui no processo de formação do AgNO3(s)?
- com os valores de DH°f
e de DG°f do AgNO3(s),
determine a entropia de formação desta substância. O resultado é compatível com a
resposta no item (a)?
- a dissolução de AgNO3(s) em água é um processo exotérmico ou
endotérmico ? E o da dissolução do MgSO4(s) em água?
- com os dados da tabela calcule a variação de entropia das dissoluções de AgNO3(s)
e de MgSO4(s) em água.
- compare e discuta os resultados do item (d), em termos da variação de entropia dos
processos de dissolução de sólidos cristalinos.
QUESTÃO 5
- 5.1)
A reação mais característica dos compostos aromáticos é a reação de
Substituição Eletrofílica Aromática. Um exemplo é a reação de mononitração do
fenol, catalisada por ácido sulfúrico.
- indique o produto ou produtos desta reação, justificando a formação do(s) mesmo(s).
- qual o agente eletrofílico gerado nesta reação?
- disponha os três nitro-fenóis isômeros em ordem crescente de acidez. Justifique.
- 5.2)
Dê as estruturas dos produtos de reação (1 e 2) da seqüência sintética
abaixo:
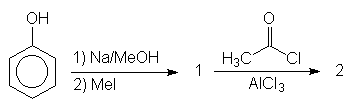
QUESTÃO 6
- Estima-se que a concentração de NO2 no ar atmosférico, em zonas
industriais, seja da ordem de 0,021 ppm.
- calcule a pressão parcial de NO2, numa amostra de ar, quando a pressão
atmosférica for de 0,98 atm.
- quantas moléculas de NO2 estarão presentes, nestas condições e na
temperatura de 20° C, num aposento de 4,5 m x 4,3 m x 2,4 m ?
- escreva as equações químicas correspondentes aos seguintes enunciados:
c.1) o dióxido de nitrogênio dissolve-se em água, formando ácido
nítrico e óxido nitroso;
c.2) a molécula de óxido nítrico sofre fotodissociação na
atmosfera superior;
c.3) na estratosfera o óxido nítrico sofre oxidação pelo ozônio.
QUESTÃO 7
- Em princípio, uma bateria poderia ser desenvolvida a partir de alumínio metálico e
cloro gasoso.
- escreva a equação balanceada que ocorre em uma bateria cujas semi-reações são: Al3+(aq)/Al(s)
e Cl2(g)/2Cl- (aq).
- diga que semi-reação ocorre no ânodo e que semi-reação ocorre no cátodo.
- calcule o potencial padrão para esta bateria (D E° ).
- se a bateria produz uma corrente de 0,75 A, quanto tempo ela irá operar se o eletrodo
de alumínio contiver 30,0 g do metal? (considere que há quantidade suficiente de cloro).
Dados:
Cl2(g)
+ 2e- ® 2 Cl- (aq) E°
= +1,36 V
Al3+(aq) + 3e- ®
Al(s) E°
= -1,66 V
Constante de Faraday = 96500 C/mol
QUESTÃO 8
- Uma reação bastante utilizada na caracterização de aldeídos e cetonas é a adição
de 2,4-dinitrofenil-hidrazina, que resulta na formação de um sólido insolúvel, amarelo
ou vermelho. Esta reação, obedece a um mecanismo bimolecular e a velocidade depende,
portanto, das concentrações do substrato (composto carbonilado) e do reagente
(2,4-dinitrofenil-hidrazina). A velocidade relativa da adição varia também de acordo
com o substrato:
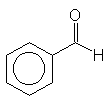 >
>
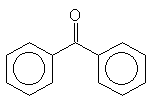 >
>
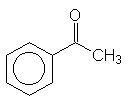
(
I )
( II )
( III )
- explique esta ordem de reatividade.
- escreva a estrutura e o nome do produto obtido na reação com o benzaldeído.
- que reação poderia ser utilizada para distinguir I de II? Explique.
- que reação poderia ser utilizada para distinguir II de III? Explique.
Informações complementares:
Elemento no. atômico
massa molar (g/mol)
Ag
47
107,8
Al
13
26,98
Cl
17
35,45
Ga
31
69,72
H
1
1,008
In
49
114,8
Mg
12
24,30
N
7
14,00
Na
11
22,99
O
8
16,00
S
16
32,07
VOLTA a menu
principal
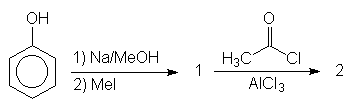
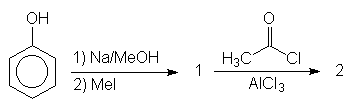
 >
>
 >
>
