O
limpíada Brasileira de QuímicaExame aplicado em 07.06.97
Problema 1Preparou-se 1 litro de uma solução A de Ba(OH)2. Foram retirados 25 mL desta solução A e titulou-se com uma solução de HCl de concentração 0,1 mol/L, havendo um consumo de 100 mL dessa solução. O restante da solução A foi abandonada ao ar, durante vários dias, formando-se um precipitado P. Este precipitado foi separado por filtração, obtendo-se uma solução límpida B. Titularam-se 25 mL dessa solução B com a solução de HCl, 0,1 mol/L, observando-se um gasto de 75 ml dessa solução. Admitindo-se que durante a exposição do restante da solução A ao ar, não houve evaporação d’água, pede-se:
a. concentração, em quantidade de matéria, da solução A;
b. concentração, em quantidade de matéria, da solução B;
c. massa, em gramas, do precipitado P.
DADOS: Considere os seguintes valores para as massas molares:
M(H) = 1 g/mol; M(O) = 16 g/mol; M(Cl) = 35,5 g/mol; M(Ba) =137 g/mol.

Determine:
a. A massa de CaO que restou do experimento.
b. A massa de CaCO3, produto intermediário deste processo.
c. A massa das substâncias gasosas que se desprenderam durante a experiência.
DADOS: Considere os seguintes valores para as massas molares:
M(H) = 1 g/mol. M(C) = 12 g/mol. M(O) = 16 g/mol. M(Ca) = 40 g/mol.
Problema 3
A molécula CO (monóxido de carbono) é isoeletrônica com N2.
a.1 - Demonstre esta identidade, usando estruturas de Lewis.
a.2 - Sabendo que:
Ligação |
Energia de ligação (Kcal/mol) |
Comprimento de ligação (Å) |
N º N |
226 |
1,09 |
C º C |
194 |
1,20 |
Especule a ordem, a energia e o comprimento de ligação da molécula de CO.
b. Por que as espécies H3, He2, HHe, H3O não existem como moléculas estáveis?
c. Sejam os seguintes valores de eletronegatividades, segundo Pauling:
H = 2,21 ; Na = 0,93 ; Br = 2,96; F = 3,98 ; Cl = 3,16 ; O = 3,44; C = 2,55 ; K = 0,82 ; Si = 1,90.
Ordene as seguintes ligações em função do caráter iônico decrescente:
F - H ; Br - H ; C - O ; Si - O ; K - Cl ; Na – F; C - H ; Br - Cl ; Si – H e K – O. Dê uma explicação geral para sua escolha.
d. Critique o uso da expressão: "moléculas de NaCl".
DADOS: Números atômicos: H = 1; C = 6; O = 8; F = 9; Na = 11; Si = 14; S = 16; Cl = 17; K = 19 e Br = 35.
Problema 4
O ar atmosférico tem uma composição aproximada, em volume, de 20,95% de O2 ; 78,09% de N2 ; 0,93% de Ar (Argônio) e 0,03% de CO2.
a. Qual processo de separação você aplicaria para isolar cada um destes componentes?
b. Determine a pressão parcial do CO2 no ar, a 1,0 atm.
c. Qual a percentagem, em peso, do O2 no ar atmosférico?
d. Quais são as relações das velocidades de difusão para os seguintes pares de gases?
I - O2 e CO2 ; II - N2 e Ar ; III - N2 e O2
e. Se na sala, em que você está realizando este exame, existem 500 L de ar atmosférico, quais as massas, em quilogramas, de cada um dos quatro componentes?
f. Quantos átomos de N2 existem em uma pulmonada de ar (0,5L) a 27º C e numa pressão de 1 atm?
DADOS: Considere os seguintes valores para as massas molares:
M(C) =12 g/mol; M(N) = 14 g/mol; M(O) = 16 g/mol; M(Ar) = 40 g/mol.
R = 8,3145 J / K . mol; R = 0,082 atm..L / K.mol; 1 atm = 101.325 Pa.
Problema 5
A montagem, abaixo apresentada, foi utilizada para o seguinte experimento. Ao se adicionar, gota a gota, uma solução de dicromato de potássio em ácido sulfúrico concentrado (cor alaranjada), contida na vidraria B sobre o álcool isoamílico existente no recipiente A, o qual está sendo aquecido suavemente através do equipamento elétrico D, obtém-se um produto volátil de odor característico, que possui a fórmula molecular C5H10O.
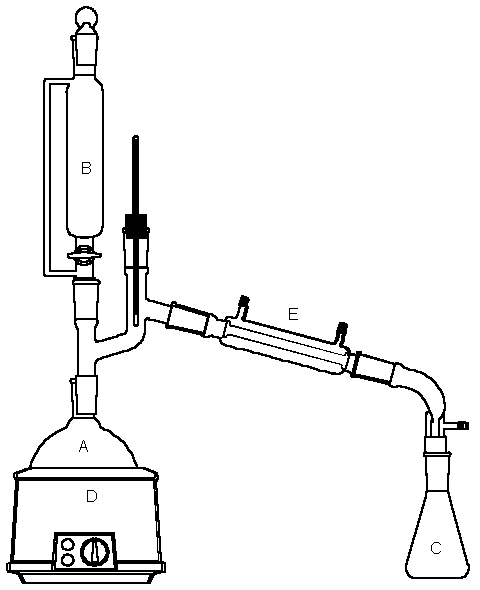
O produto volátil conseguido na reação, à medida que vai sendo formado, é destilado através do instrumento E acoplado ao vaso A, sendo coletado no recipiente C. Depois de separado da água, que co-destila junto ao produto, este é submetido a vários testes habituais de laboratório para melhor identificação. Os resultados destes testes estão resumidos na tabela abaixo.
Teste realizado: |
Resultado obtido: |
1. Teste de Tollens (Ag [NH3]2OH ) |
Positivo |
2. Teste de Lucas (HCl com. + ZnCl2 ) |
Negativo |
3. Teste com 2,4-Dinitrofenilhidrazina |
Positivo |
4. Teste do Iodofórmio (Iodo / HO- ) |
Negativo |
6. Teste com NaHCO3 diluído |
Negativo |
5. Teste com Bromo / CCl4 |
Negativo |
Pergunta-se:
a. Qual a fórmula estrutural do composto obtido?
b. A qual função pertence o composto produzido?
c. Qual a mudança de cor observada no vaso de reação A ?
d. Por que o produto da reação deve ser destilado à medida que vai sendo formado no vaso de reação A?
e. Qual o tipo de reação que ocorreu entre o álcool isoamílico e o dicromato de potássio em ácido sulfúrico?
![]()
f. Observe a figura e identifique cada um dos instrumentos de laboratório A, B, C, D e E utilizados na experiência.
Problema 6
O odor agradável de algumas flores e frutas é resultante da presença, em seus óleos essenciais voláteis, de substâncias orgânicas pertencentes a várias e diferentes funções, destacando-se os ésteres. Em alguns destes ésteres, o odor é tão marcante e característico que, por este fato, passaram a ser reconhecidos pelo nome dos frutos nos quais os odores predominam.
a. Represente as fórmulas estruturais das essências artificiais, cujos nomes seguem associados aos nomes vulgares.
a.1 Essência de morango (acetato de isobutila).
a.2 Essência de abacaxi (butirato de etila).
a.3 Essência de maçã (isovalerato de isoamila).
b. Os compostos pertencentes à função éster poder ser obtidos por reação entre compostos pertencentes a duas diferentes funções precursoras. Nestas reações, o ácido sulfúrico é usado como catalisador. Equacione a reação que leva à obtenção do benzoato de benzila.
c. A reação de hidrólise ácida de um éster é o reverso, isto é, tem o sentido oposto da reação de esterificação. Escolha um dos ésteres cuja fórmula estrutural foi desenvolvida como resposta no quesito a e a partir dela demonstre por equação o que se entende por hidrólise.
d. No grupo funcional dos ésteres podem ser observados dois diferentes tipos de átomos de oxigênio: um encontra-se duplamente ligado a carbono, e o outro faz ponte ligando-se a dois átomos de carbono. Empregando dados mecanísticos prove, por meio de equações, que o O (oxigênio) da ponte se origina de uma hidroxila alcoólica, e não de uma carboxila ácida.
Problema 7
Quando mergulhamos um metal em meio aquoso, que contém íons do próprio metal (semi-célula), aparece no equilíbrio uma diferença de potencial entre o metal e o meio aquoso.
Problema 8
As energias-livres de formação do etileno (C2H4) e do etano (C2H6), a 25 oC e 1 atm são, respectivamente, +68,06 kJ/mol e –32,85 kJ/mol. Suas entalpias-padrão de formação são +52,23 kJ/mol e – 84,58 kJ/mol.
Pergunta-se:
a. Para a redução do etileno a etano com H2, a 25 oC e 1 atm, determine a variação da energia livre e a variação da entropia.
b. Como se modificaram a energia e a desordem do sistema?
c. A reação é espontânea? Justifique.
d. Como a temperatura modificaria a espontaneidade da reação?