a. Encontre a distância I-I em cada um dos compostos isoméricos C2H2I2.
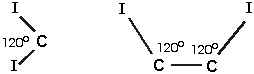
O
limpíada Brasileira de Química - 1996Exame aplicado em 24.08.96
Em um cadinho foi colocada uma mistura de carbonato de sódio decahidratado e carbonato ácido de sódio. Após aquece-la na mufla restou unicamente carbonato de sódio, verificando-se uma perda total de peso na ordem de 16 gramas. Se a quantidade de CO2 seco desprendido do cadinho foi de 4,4 g e as reações ocorridas foram:
Na2CO3
.10 H2O ® Na2CO3 + 10 H2O2 NaHCO3
® Na2CO3 + H2O + CO2Determine a quantidade, em gramas, de Na2CO3 .10 H2O existente na mistura.
DADOS: M (H) =1 g/mol; M (C) = 12 g/mol; M (O) = 16 g/mol; M (Na) = 23 g/mol
O hidrogênio é preparado em grande escala por diversos métodos.
a. Passando vapor dágua sobre coque, C, aquecido ao rubro obtém-se gás de água, que é uma mistura de CO e H2. Trata-se de um combustível industrial importante, pois é fácil de obter e queima liberando grande quantidade de calor. Escreva as equações químicas destes dois processos.
b. Hidretos salinos, em contacto com a água, também produzem hidrogênio:
LiH + H2O
® LiOH + H2Descreva e ilustre com exemplos:
- hidretos iônicos ou salinos.
- hidretos covalentes ou moleculares.
- hidretos metálicos ou intersticiais.
c. Mostre através da eletrólise de soluções de NaOH e KOH, numa célula com ânodos de níquel e cátodos de ferro, como o hidrogênio pode ser obtido. Escreva as semi-reações do ânodo e cátodo e a reação total.
d. Em refinarias de petróleo, misturas naturais de hidrocarbonetos de elevada massa molar, tais como nafta e óleo combustível, são submetidas ao processo de craqueamento para formar novas misturas com hidrocarbonetos de menor massa molar que podem ser usados como gasolina. O hidrogênio é um subproduto deste processo. Descreva-o e apresente as reações.
Problema 3
a. Encontre a distância I-I em cada um dos compostos isoméricos C2H2I2.
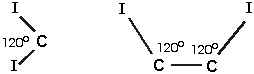
Raios de ligações covalentes, C - I = 2,10 pm; C = C = 1,33 pm; pm = 10-12 m
b. Nas moléculas
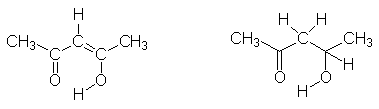
ocorrem ligações de hidrogênio intermoleculares (pontes de hidrogênio). Em quais delas estas ligações são mais estáveis? Justifique sua resposta.
c. O ângulo de ligação em
SnCl2 é 120o e o ângulo em I3- é 180o. Explique as diferenças, em termos de repulsões eletrônicas.d. Determine a geometria de cada uma das seguintes espécies e hibridações de cada átomo central:
PbCl4 , PF6- e AlH3
e. Para cada um dos pares indicados, qual espécie deve apresentar maior ângulo de ligação? Justifique sua resposta.
I) H2O e NH3 ; II) SF2 e BeF2
Problema 4
1a. KMnO4 em meio básico e água.
1b. KMnO4 em meio ácido.
1c. ozônio e água.
2a. Na reação 1c são obtidos 2 (dois) produtos, que tipo de isomeria eles apresentam?
2b. Escreva as reações que representam processos através dos quais podem ser produzidos, separadamente, os produtos da reação 1c.
Problema 5
Sejam os compostos orgânicos:
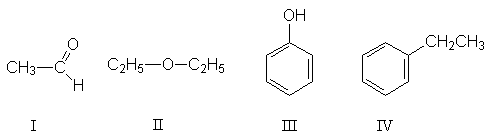
a. Qual a função e dê os nomes, segundo a nomenclatura IUPAC, para cada substância.
b. Cite os principais usos do composto III.
c. Mostre como se prepara o composto I através da redução de cloretos de ácidos.
d. Complete as reações:
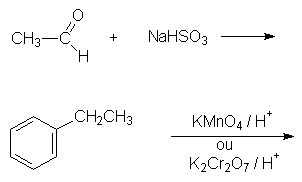
Problema 6
Os dados abaixo foram obtidos para a reação de 1a ordem
A
® ProdutosMedida |
a |
b |
c |
d |
e |
f |
Tempo(min) |
0 |
5 |
10 |
15 |
20 |
25 |
[A] mols/L |
0,5 |
0,36 |
0,26 |
0,19 |
0,14 |
0,10 |
Log [A] |
- 0,301 |
- 0,444 |
- 0,585 |
- 0,721 |
- 0,854 |
- 1,0 |
a. Calcule a velocidade instantânea em 17,5 min, se o volume é constante. A tangente à curva, neste ponto, possui coordenadas (8,4; 0,25) e (29,4; 0,05).
b. Calcule a velocidade aproximada entre 5 e 10 min (pontos b e c) e entre 20 e 25 minutos (pontos e, f).
c. Para este tipo de reação, estudos mostram que na plotação de Log [A] versus tempo (linha reta) a inclinação a = - k/2,303 (y = ax + b) onde k = constante de velocidade. Calcule a constante de velocidade para esta reação.
Problema 7
A figura representa um equipamento montado para se verificar uma reação de óxido-redução.
A experiência tem início com a montagem das vidrarias. Inicialmente, colocam-se 6,5 g de zinco no utensílio AA, completando o volume com água até um nível onde a haste da vidraria AB possa ficar submersa.
Montada a primeira parte do equipamento e estando as vidrarias devidamente presas ao suporte, faz-se a ligação deste com um tubo horizontal onde há CaCl2 anidro. Antes de fazer a conexão com a terceira parte do instrumento, introduz-se 1 mL de CuSO4.5H2O de concentração 3 mol/L através da vidraria AA e, após encher na vidraria AA com H2SO4, lentamente, abre-se a torneira.
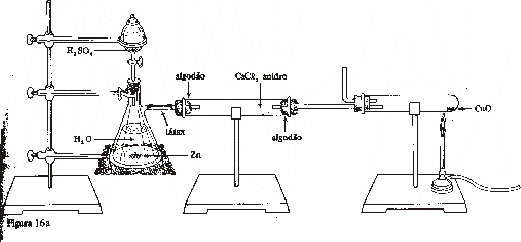
1. Identifique os utensílios assinalados como AA, AB, AC, AD e cite suas principais formas de utilização em um laboratório.
2. Após gotejar H2SO4 no recipiente AB observa-se evolução de um gás.
2a. Qual a composição deste gás?
2b. Escreva a equação desta reação.
2c. Se há bastante ácido, qual a máxima quantidade, em gramas, do gás produzido.
2d. Por que a haste do utensílio AA deve ficar submersa nágua?
3. Após fluir durante alguns minutos, o gás atravessa o tubo horizontal. Ao acender um fósforo em sua extremidade ocorre uma leve explosão. Repetir, outras vezes, esta ação até que não mais se observe explosões.
3a. Qual a causa da explosão?
3b. O que restou no interior deste tubo?
3c. Qual a função do CaCl2 presente neste tubo?
4. Conecta-se, agora, a terceira parte do instrumento, a vidraria AC, que tem no seu interior 1,6 g de CuO. Aquecer o CuO até total eliminação desta substância e conseqüente formação de uma substância vermelha no interior da vidraria.
4a. Que alterações o calor provoca sobre a substância CuO?
4b. Qual a ação do gás gerado no recipiente AB sobre o CuO?
4c. Se a aparelhagem indicada demonstra um processo de óxido-redução, descreva-o e indique os agentes oxidante e redutor.
DADOS: M (H) = 1 g/mol; M (Zn) = 65 g/mol.
Problema 8
A figura mostra a aparelhagem utilizada para observar a eletrólise de uma solução aquosa de iodeto de potássio.

Uma solução de KI é posta no tubo em U até atingir, aproximadamente, ¾ de seu volume. Após ligar a fonte de corrente contínua, observa-se a ocorrência da eletrólise durante 15 minutos. No eletrodo onde bolhas de gás são formadas, colocam-se 4 (quatro) gotas de fenolftaleína.
a. Qual o gás liberado no cátodo?
b. Por que em torno do cátodo observa-se coloração.
c. Dê as reações que ocorrem, isoladamente, no ânodo e no cátodo e a reação total.
d. Que aconteceria se a solução de KI fosse substituída por uma solução de NaCl?
e. Por que em torno do ânodo a solução fica marrom escuro?
f. Qual a razão de aplicar corrente contínua?