- B
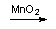 Y + A
Y + A - A ® X
- B ® Z + C
Fase III (Etapa 1 nacional)
Exame aplicado em 01.09.2001
Os compostos do elemento químicos Q são vastamente distribuídos na natureza, no entanto, ele raramente ocorre como elemento. O elemento Q não possui qualquer modificação alotrópica. Na reação com oxigênio ele forma os produtos A e B com diferentes composições quantitativas.
O composto A é neutro sem qualquer propriedade oxidante ou redutora notável. Nas reações do composto A com compostos binários, podem ser obtidos ácidos e bases. As reações que ocorrem não são reações redox.
O composto B possui ambas propriedades, oxidantes e redutoras. Na reação com oxidantes fortes (por exemplo, KMnO4, em meio ácido) o composto B comporta-se como redutor, sendo oxidado para a substância elementar Y. Quando aquecido na presença de MnO2, o composto B desproporciona (isto é, o elemento é um agente oxidante e redutor, ao mesmo tempo) para dar a substância elementar Y e o composto A.
A redução do composto A usando metal ativo produz o elemento Q como uma substância elementar X e um composto D, que pode reagir com ácidos e óxidos ácidos com a formação da substância a.
O composto B pode oxidar o iodeto de potássio, produzindo uma substância elementar diatômica Z e um hidróxido C.
d. Escreva as equações para as seguintes reações redox e especifique os números de oxidação dos elementos:
A análise química de um composto orgânico (um líquido incolor em CNTP) dá 14,40 % de hidrogênio (por massa). Quando 0,870 g deste composto é queimado completamente na presença de oxigênio e os produtos da combustão são borbulhados através de um excesso de água de cal, são formados 6,20 g de um precipitado. A gravidade específica dos vapores do composto acima citado, em relação ao ar seco, é aproximadamente 2,5 vezes a do etano.
Dados:
Massas atômicas (valores aproximados, em g/mol): H =1; C = 12; O = 16; Ca = 40
a) Calcular o decréscimo de massa do eletrodo de zinco, se uma corrente de 0,15 A, passa através da célula galvânica abaixo, durante 1,5 h:
Zn(s)ú Zn2+(aq) ú ú Cu2+(aq) ú Cu(s)
b) Calcule o potencial padrão de redução da célula abaixo, a 25° C, sendo a concentração de Zn2+ igual a 0,1 mol/L e a de Ag+ igual a 0,01 mol/L (E° = 1,56 V)
Zn(s)ú Zn2+(aq) ú ú Ag+(aq) ú Ag(s)
c) Dar a equação química da reação que ocorre espontaneamente na célula galvânica que consiste das seguintes meia-células:
MnO2 + 4H+ + 2e- ® Mn2+ + 2 H2O E° = 1,21 V
Ag+ + e- ® Ag E° = 0,80 V
Dados:
Constante de Faraday (F) = 96485 C/mol de elétrons
Massas atômicas (valores aproximados, em g/mol): Zn = 65,4; Cu = 63,5; Ag = 108
Um frasco contém sódio metálico contaminado com óxido de sódio (Na2O) e cloreto de sódio. Uma amostra desse metal contaminado, pesando 0,500 g foi dissolvido em água:
a) Escreva as equações químicas para as duas reações que ocorrem quando a amostra é dissolvida em água.
Quando 0,500g dessa amostra de metal contaminado é dissolvido em água, são formados 249 cm3 de hidrogênio, a uma pressão de 98,0 kPa, a 25 ° C. Esta solução foi diluída com água para um volume de 250,0 cm3 e 25,0 cm3 foram titulados com uma solução de HCl de concentração 0,112 mol/dm3. Para neutralização foram gastos 18,2 cm3 da solução de ácido:
b) Calcule a massa de hidrogênio gasoso formado;
c) Escreva a equação química para a reação de titulação e calcule a quantidade de hidróxido de sódio formado na reação entre a água e a amostra;
d) Calcule as quantidades de sódio e óxido de sódio na amostra;
e) Calcule as porcentagens (em massa) de sódio, óxido de sódio e cloreto de sódio na amostra.
Dados:
1 atm = 1,01325 x 105 Pa
Constante universal dos gases (R) = 0,08206 atm.L.K-1.mol-1 ou 8,3145 Pa.dm3.K-1.mol-1
Massas atômicas (valores aproximados, em g/mol): H = 1; O = 16; Na = 23; Cl = 35,5
Questão 5
A queima de metano na presença de oxigênio pode produzir três produtos distintos, contendo carbono: fuligem (partículas muito pequenas de grafite), monóxido de carbono gasoso e dióxido de carbono gasoso.
Dados:
D Hf° (kJ/mol) ® CO(g) = -110,5; CO2(g) = -393,5 H2O(l) = -285,83 CH4(g) = -74,81
Questão 6
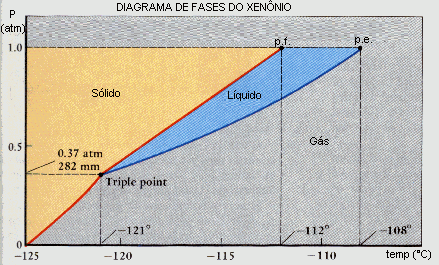
Considerando o diagrama de fases do xenônio, apresentado abaixo, responda às questões que seguem:
Questão 7
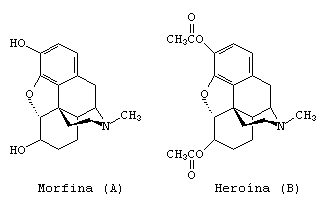
A heroína (B) pode ser obtida a partir da reação da morfina (A) com anidrido acético:
Questão 8
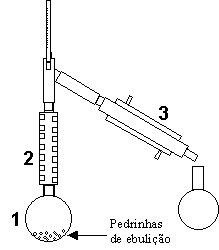
Uma mistura de isômeros geométricos, de fórmula C4H8, é submetida à destilação fracionada. O esquema abaixo ilustra o sistema de vidrarias usado neste experimento.