Exame aplicado em 30.09.2000
| Composto | DHf° (kJ.mol-1) | S° (J.K-1.mol-1) |
|
-333,51 | 104,60 |
|
-285,83 | 69,91 |
|
-241,82 | 188,83 |
|
-393,51 | 213,74 |
|
-46,11 | 192,45 |
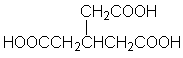
a. Considere a hidrólise de uréia com H2O (l) (Reação A) e com H2O (g) (Reação B), respectivamente. Calcule DH°, DS° e DG° , a 25 °C, para cada reação e especifique se a reação é espontânea ou não.
b. Considerando que ambos, DH° e D
S°, são independentes da temperatura, encontre a temperatura na qual a Reação A ocorrerá espontaneamente.c. Calcule Kp a 25 °C para cada reação, expressando esse valor em unidades apropriadas.
R = 8,314 J. K-1 . mol-1.
|
 |
|
|
|
|
|
|
|
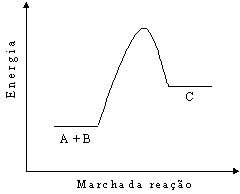
- Au3+(aq) + 3 e- ® Au (s) E° red = + 1,498 V
- AuCl4- (aq) + 3 e- ® Au (s) + 4 Cl- (aq) E° red = + 1,002 V
- NO3- (aq) + 4 H+(aq) + 3 e- ® NO(g) + 2 H2O(l) E° red = + 0,96 V
|
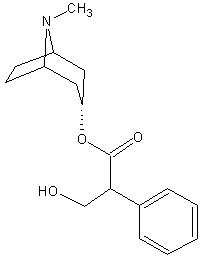 |
| b. Apesar de possuir carbonos assimétricos a tropina é opticamente inativa. Explique | |
|