UNIVERSIDADE
FEDERAL DO CEARÁ
CENTRO
DE CIÊNCIAS
Questão
1
Em
uma análise química desejava-se determinar o teor percentual de zinco em
96,57g de uma amostra de um sal de Zn2+. Esta amostra foi
solubilizada em 100mL de HCl 1,2 mol/L e diluída para 1 L. Uma alíquota de
100mL desta solução foi retirada e submetida a uma resina de troca catiônica
(Res-H+), que contém como contra-íon H+. A
solução obtida foi neutralizada por titulação com 154 mL de NaOH 1 mol/L.
a)
Expresse a equação de troca iônica da resina.
b)
Determine o teor percentual do zinco na amostra.
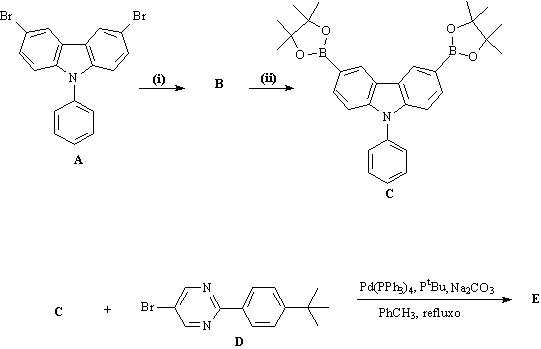
O
esquema abaixo representa a síntese de um produto orgânico com características
de um OLEDs (Organic Ligth Emitting Diodes). Proponha as estruturas dos
reagentes (i) e (ii), bem como dos compostos B e E.

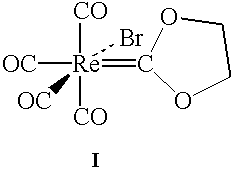
Quando
o composto I é adicionado a uma solução, em tolueno, contendo excesso de
trifenilfosfina (PPh3) e a
mistura é aquecida a refluxo, primeiro o composto II é formado, e em seguida o composto III. O espectro de infravermelho de II mostra bandas em 2038, 1958, e 1906 cm-1, e de III
mostra bandas em 1944 e 1860 cm-1. Os dados de RMN de 1H e
13C estão apresentados na tabela abaixo:
|
Composto |
d,
ppm 1H (área) |
d,
ppm, 13C |
|
I |
4,83
s |
224,31 187,21 185,39 184,01 73,33 |
|
II |
7,62
, 7,41 m (15) 4,19
m (4) |
231,02 194,98 189,92 188,98 129,03
– 134,71 (vários picos) 72,76 |
|
III |
7,70,
7,32 m (15) 3,39
s (2) |
237,19 201,85 193,83 127,75
– 134,08 (vários picos)
68,80 |
s = singleto, m = multipleto
Informações
adicionais úteis: o sinal de 13C para o composto I
em 224,31 ppm é similar deslocamento químico de carbonos carbeno em compostos
similares; os picos entre d 184 e 202 ppm correspondem ao ligante carbonil; e o pico em
d 73,33 ppm é típico para CH2CH2 em ponte nos complexos
dioxocarbeno.
Identifique
os compostos II e III
e compare a intensidade de backbonding
ReàCO
nos dois compostos.
Questão
4
b)
Acima do ponto crítico, como a densidade se apresenta?
a)
HClO2 + 3H+ + 2 e- à
HClO + H2O
Eo = 1,65 V
b)
HClO + H+ + 2 e- à
Cl2 + H2O
Eo = 1,67 V
c)
ClO4- + 2 H+ + 2 e- à
ClO3- + H2O
Eo = 1,20 V
d)
ClO3- + 3H+ + 2 e- à
HClO2 + H2O
Eo = 1,18 V
e)
Cl2 + 2 e- à
2Cl-
Eo = 1,36 V
DADOS:
Números
atômicos:
U -
92; At –
85; Th – 90; Pa – 91;
Ra – 88; Rn
– 86; Po - 84
Questão 5
E
=
h
wo
(n
+ p + 1), n, p =
0, 1, 2, . . . onde h
é a constante de Planck, wo
é a
freqüência natural de oscilação do
n,
p
2 p
oscilador
e n e p são os números quânticos
principais.
5-1 Construa um diagrama dos níveis de
energia, incluindo os 21 primeiros orbitais.
5-2 Sabendo-se que a molécula possui 26
elétrons, determine o número de elétrons presentes nos orbitais ocupados do nível
de mais alta energia do estado fundamental.
5-3
Assumindo que a regra de Hund possa ser aplicada a esse sistema, determine se o
sistema é paramagnético ou diamagnético. Justifique a sua resposta.
5-4
Luz é absorvida somente quando a condição hν
= ΔE é satisfeita. Qual é o maior comprimento de onda da luz que pode
levar a molécula do estado fundamental a um estado excitado?
Abaixo
são dados os espectros de massa de cinco compostos orgânicos halogenados, A-E.
Dadas as porcentagens relativas dos isótopos de Cloro (35Cl 75,77%; 37Cl
24,23%) e de Bromo (79Br 50,7%; 81Br 49,3%) em sua abundância
natural, pede-se, com base na intensidade conferida pela contribuição isotópica
para o íon molecular, o tipo e o número de halogênio(s) presente em cada
substância.
|
A |
|
|
B |
|
|
C |
|
|
D |
|
|
E |
|
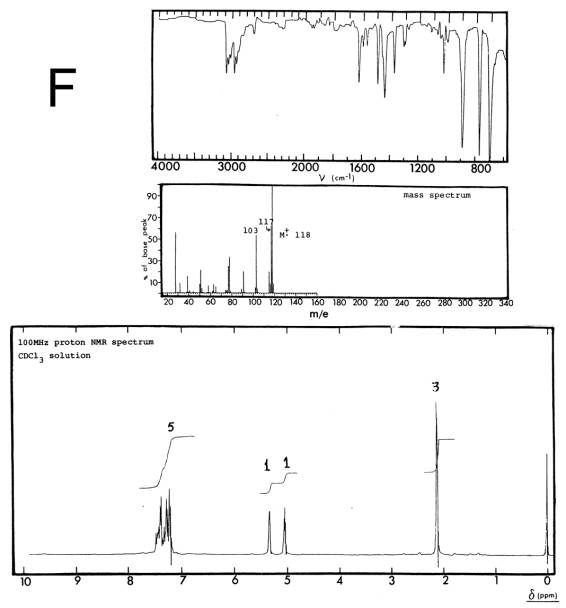
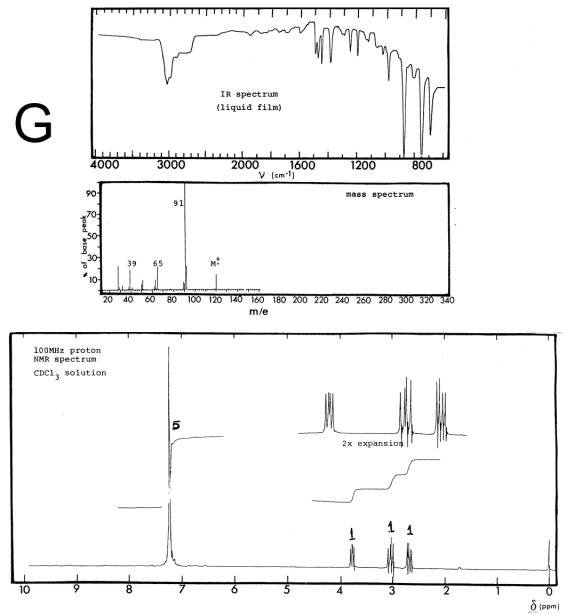
Abaixo
são dados os espectros de massa (70eV), infravermelho (filme) e RMN 1H
(100 MHz, CDCl3) das substâncias F (91,5% C; 8,5% H) e G (80,0% C;
6,7% H). Com relação a isto pede-se: