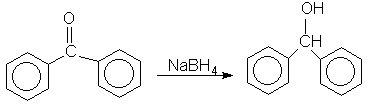
EXAME EXPERIMENTAL
, aplicado em 12.10.96 (10h as 15h)
PROBLEMA EXPERIMENTAL No 1
Uma das tarefas que você deverá realizar nesta manhã consiste em ajudar-nos a identificar um oxalato cuja etiqueta foi parcialmente deteriorada por uma goteira existente em um antigo depósito de reagentes. Trata-se então de um oxalato de fórmula desconhecida [Mx(C2O4)z] e sua tarefa nesta parte será identificá-lo. Para isso, você deverá determinar experimentalmente o valor do produto de solubilidade do oxalato e compará-lo com os valores que se encontram na bibliografia, na página seguinte, e que são apresentados na listagem correspondente.
A seguir são apresentados todos os passos que lhe permitirão determinar o valor do produto de solubilidade usando a conhecida lei de Lambert -Beer*.
Para agilizar seu trabalho, os dois primeiros passos já foram efetuados pela equipe de professores.
1. Preparou-se uma solução saturada do correspondente oxalato e foi deixada até atingir o equilíbrio, a pressão e temperatura constantes (25
° C), durante meia hora.2. Para evitar possíveis mudanças de solubilidade durante o trabalho posterior (que não será efetuado a temperatura constante), tomou-se uma alíquota da solução sobrenadante e diluiu-se com um volume igual de água destilada (diluição 1:1). Esta solução é a amostra X, e é a que você utilizará nos passos seguintes do experimento, sem inverter a ordem do procedimento. Seu trabalho experimental se inicia a partir do seguinte passo:
3. Preparar a(s) solução(ões) que você vai utilizar para medir as absorbâncias, usando a seguinte técnica.
a) Retirar um volume de 10,00 mL da solução etiquetada como amostra X e verte-lo em um balão volumétrico de 25,0 mL.
b) Acrescentar ao mesmo balão volumétrico, 10 mL de H2SO4 3 mol/L (se, por acidente, cair um pouco desta solução na sua pele, lave-a abundantemente com água corrente).
c) Acrescentar 1,00 mL da solução de KMnO4 (
aproximadamente, 0,01 mol/L)d) Completar o volume de 25,0 mL adicionando água destilada até a marca de calibração.
e) Preparar um branco adequado para realizar as medidas de absorbância que permitam resolver o seu problema.
f) Durante 2 minutos, aquecer em banho-maria (com a temperatura controlada entre 40o e 50oC) tanto o branco como a(s) solução(ões) preparada(s).
g) Deixar esfriar para efetuar a medida de absorbância (A) da solução.
Nota: O comprimento de onda de trabalho é 526 nm, a célula de medida (ou cubeta) tem um comprimento de 1 cm (ou caminho óptico) e o valor da absortividade molar (
e ) do permanganato neste comprimento de onda é aproximadamente 2.850 L.mol-1 cm-1. O valor exato lhe será dado no momento de realizar suas medidas.*
No caso de você não se lembrar, solicite a um professor que lhe diga a fórmula, mas saiba que perderá pontuação deste item.Lembre-se que qualquer determinação deve ser efetuada triplicadamente. Não se esqueça de ler as perguntas apresentadas na folha de respostas pois isso vai ajudá-lo a compreender a fundamentação do método e a planejar adequadamente a forma de proceder antes de começar o experimento. Leve em consideração o material que você dispõe.
Para efetuar as medidas de absorbância você será ajudado por um professor do laboratório a quem você deverá apresentar as soluções que deseja medir e a solução que você quer utilizar como branco. Caberá a você decidir qual o branco mais adequado. Lembre-se de que o branco é indispensável para eliminar qualquer interferência na sua determinação.
Você tem direito a pedir que sejam efetuadas, no máximo, até seis medidas de absorbância, mas preste atenção que o problema pode ser solucionado com uma única medida de absorbância para cada amostra preparada. Isto é, o seu problema pode ser resolvido com apenas três medidas (uma para cada amostra preparada).
Observe o tempo que você levará para obter os seus resultados e não deixe para realizar as medidas de absorbância no final da prova.
VALORES DE pKs DOS POSSÍVEIS OXALATOS PRESENTES NA AMOSTRA
Composto |
Valor de pK s |
Ag2C2O4 |
10.65 |
Cu C2O4 |
6.40 |
Ba C2O4 |
5.85 |
Cd C2O4 |
7.40 |
ZnC2O4 |
7.90 |
Materiais e reagentes:
Solução de KMnO4 @ 0,01 mol/L Solução de H2 SO4 @ 3 mol/L Solução da amostra X 5 balões volumétricos de 25,0 mL 1 proveta de 50 mL |
1 propipeta 1 pipeta de 1,0 mL 1 pipeta de 10,0 mL Pisseta com água destilada |
1. Escreva a reação iônica balanceada entre o oxalato e o permanganato em meio ácido:
Dados: Eo ( V/ENH) pH=0 MnO4- / Mn2+ = 1,51 e CO2 /C2O42- = - 0,49
2. Escreva a expressão matemática da lei de Lambert-Beer (no caso de não lembrar, você poderá solicitar a um professor esta informação, mas será anulada a pontuação deste item):
3. Escreva a fórmula dos compostos e o volume das soluções de cada um destes compostos utilizados para preparar o branco que você escolheu:
4. Valores de absorbância das soluções medidas.
a) _________________ b) _________________ c) _________________
Valor de absorbância que você utilizará em seus cálculos: ______________
5. Medidas adicionais de absorbância que você tenha efetuado (somente nos caso em que foi necessário realizá-las). Indique a(s) solução(ões) media(s):
Valor |
Solução |
6. A concentração de C2O4 2- na amostra X é: _____ mol/L.
7. A solubilidade do composto M
x (C2O4 )y desconhecido é: _____ mol/L.8. O valor de pK
s que você determinou é:9. Indique todos os cálculos que você efetuou para chegar ao valor de pKs
10. Portanto, a fórmula do composto M
x (C2O4 )y é:
PROBLEMA EXPERIMENTAL No 2
IDENTIFICAÇÃO DE BENZOFENONA E SÍNTESE DO DIFENILCARBINOL (Benzidrol)
MATERIAL E REAGENTES
| Balão com boca esmerilhada Condensador com mangueiras 2 recipientes de 150 ml Kitasato Funil de Büchner com extensão Mangueira de vácuo Papel filtro Proveta de 25 ml Frasco para cromatoplaca com eluente (acetato de etila) Frasco p/ cromatoplaca c/ revelador (iodo) Espátula Vidro de relógio Capilares Funil Pinças de três pontas na extremidade |
Pipeta de 5 ml 10 tubos de ensaio Banho para aquecimento Papel pH Recipiente para guardar o produto obtido Frasco com borohidreto de sódio Frasco com solução de benzofenona para a cromatoplaca. 6 frascos conta-gotas que contém : Solução de 2,4 dinitrofenilhidrazina Água de bromo Solução de iodo-iodeto de potássio HCl a 10% NaOH a 10% Metanol (CH3OH) |
Seu trabalho será conduzido em duas etapas :
a. A primeira parte consiste em identificar dentre três compostos, qual deles é a benzofenona .
b. A segunda, é a redução da benzofenona a benzidrol de acordo com a seguinte reação :
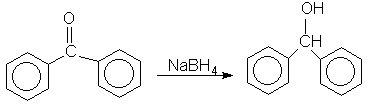
A seguir, descrevem-se detalhadamente as operações que você deve realizar em cada caso.
IDENTIFICAÇÃO DA BENZOFENONA
Em sua mesa de trabalho você tem três amostras em solução, etiquetadas com as letras A, B e C, uma delas é a benzofenona e as outras duas são substâncias desconhecidas. Você deverá determinar qual das três é a benzofenona e quais grupos funcionais estão presentes nas outras duas amostras. Para isto, você dispõe de: solução de 2,4- dinitrofenilhidrazina, água de bromo e os reagentes necessários para que você realize a prova do halofórmio.
Em seguida mostramos como você deve proceder para realizar cada uma destas reações:
Prova da 2,4 dinitrofenilhidrazina:
Em um tubo de ensaio ponha, aproximadamente, 2 gotas da solução-problema, e 10 gotas da solução do reagente 2,4 - dinitrofenilhidrazina. Se for necessário, aqueça-a em banho-maria por 5 minutos.
Prova do halofórmio:
Em um tubo de ensaio pequeno coloque 1 ml de água, seis gotas da solução do composto desconhecido e 20 gotas da solução de iodo-iodeto de potássio, adicione gota a gota e agitando a solução de NaOH a 10%.. Espere 3 minutos para certificar-se de que o teste foi positivo.
Prova da água de bromo
Em um tubo de ensaio coloque 4 gotas da solução da substância-problema e adicione a água de bromo.
ANOTE EM SUA FOLHA DE RESPOSTA, OS RESULTADOS OBTIDOS NAS TRÊS PROVAS ANTERIORES.
OBTENÇÃO DO BENZIDROL
Dentro do balão já está a benzofenona (0,5g) necessária para a sua reação e pedras de ebulição necessárias para controlar a ebulição.
O primeiro passo da reação consiste em dissolução da benzofenona: para isto adicione ao balão todo o metanol, retire-o do suporte com muito cuidado e agite-o suavemente. Depois, reuna lenta e cuidadosamente todo boridreto de sódio: esta operação deverá ser feita com muito cuidado porque é uma reação muito exotérmica. Prenda novamente o balão no suporte e adapte o condensador em posição de refluxo (verifique se a torneira de água está aberta). Para completar sua reação você precisa aquecer; e para isto, introduza o balão em banho-maria e conecte o aparelho na corrente elétrica (certifique-se que existe água antes de ligá-lo). Anote o tempo quando a mistura começar o refluxo e a partir deste momento, conte 20 minutos. Evite que a água do banho-maria se derrame; sendo necessário desligue-o.
Depois deste tempo, suspenda o aquecimento, desligue o banho-maria e com cuidado retire o balão. Espere 10 minutos para que se resfrie, tire o condensador, feche a água do condensador e transfira a mistura de reação para um recipiente de precipitados.
Neste momento você conclui o processo, porem, é provável que toda a benzofenona não tenha reagido ainda, isto você deverá demonstrar pelo menos de duas formas.
Para isto use os reagentes para provas de identificação que você dispõe e o jogo para cromatografia de placa fina.
Depois de revelar a placa, marque com um lápis as manchas que aparecem, desenhe-a no lugar indicado, e junte-a na folha de respostas.
Escreva os resultados destas duas provas na folha de respostas.
Uma vez realizadas suas provas, acrescente 5 mL de água ao recipiente em que se encontra a mistura reacional e aqueça-o em banho-maria por cinco minutos. Após este tempo, acrescente 2 mL de ácido clorídrico a 10% e continue o procedimento, gota a gota desta solução, até alcançar um pH ligeiramente ácido.
Prepare o sistema de filtração a vácuo e lave o precipitado obtido. Quando considerar que esteja seco, desligue o vácuo e, utilizando uma espátula, transfira o seu produto para um saco plástico. Pese o produto e anexe o saco plástico a folha de respostas.
IDENTIFICAÇÃO DE BENZOFENONA
Escreva os seus resultados no quadro abaixo, marcando com um sinal (+) quando a prova for positiva e com um sinal (-) quando a prova for negativa.
.
Prova |
Amostra A |
Amostra B |
Amostra C |
de 2, 4-dinitrofenilhidrazina |
|||
de halofórmio |
|||
de água de bromo |
Como conclusão responda as seguintes perguntas:
Grupos funcionais presentes na amostra A _________________________
Grupos funcionais presentes na amostra B __________________________
Grupos funcionais presentes na amostra C _________________________
Portanto, a benzofenona está na amostra __________________________
OBTENÇÃO DO BENZIDROL
I) Informações sobre a prova utilizando os reagentes.
a) Escreva a reação que lhe permite estabelecer se restou benzofenona sem reagir, utilizando os reagentes disponíveis:
b) Restou benzofenona sem reagir ? SIM _______ NÃO ______
II) Informações da cromatoplaca

b) Restou benzofenona sem reagir ? SIM _____ NÃO _____
NOTA IMPORTANTE: É possível que as respostas encontradas para as perguntas I b) e II b) não coincidam. Isto não significa que haja um erro.
III) Cálculo de Rendimento:
O rendimento da reação é: _________________ %
II
Olimpíada Ibero-americana de QuímicaEXAME TEÓRICO
, aplicado em 14.10.96 (10h as 15h)PROBLEMA 1. Química Inorgânica.
No diagrama aparecem as etapas realizadas para identificar os cátions metálicos presentes na fração solúvel de um mineral que foi atacado com ácido clorídrico
À solução vermelho-púrpura intenso da última prova (A), é adicionada NaOH concentrado e um excesso de sulfito de sódio. A solução adquire uma cor verde escuro (B) que, com aquecimento, desaparece, formando um precipitado de cor negra (C).
O precipitado negro é tratado com ácido clorídrico, obtendo-se uma solução incolor (D) e um gás irritante com propriedades descolorantes (E), que contém 63% em massa do elemento metálico.
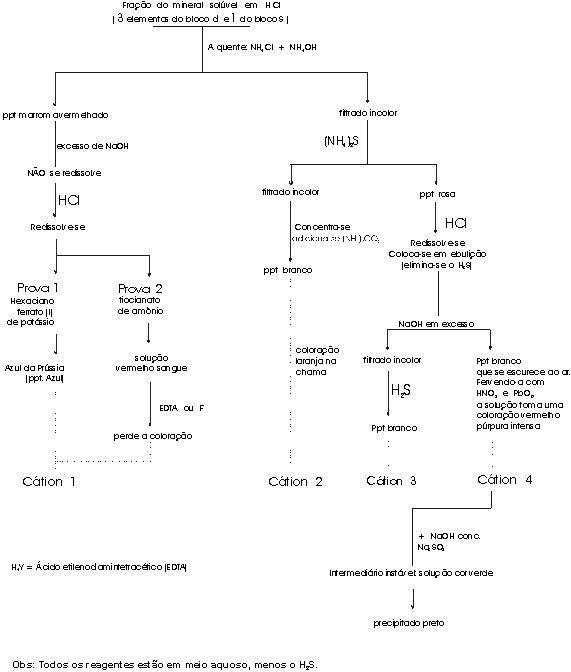
PERGUNTAS:
1. Mencionar três ânions que poderiam estar presentes no mineral original.
2. a) Escrever a configuração eletrônica do cátion 1.
b) Dar a fórmula do precipitado marrom avermelhado.
c) Escrever a equação balanceada da reação de descoloração da solução vermelho sangue.
d) O azul da Prússia (ppt. azul) é um sal. Escreva sua fórmula.
3. a) A que família pertence o cátion 2?
b) Este cátion é identificado quando está presente em uma substância muito abundante na Terra, tanto no reino mineral como no animal. Qual é a fórmula deste composto?
c) Mencione três exemplos de materiais naturais onde se encontra o composto mencionado em b).
4. a) Qual(is) é(são) o(s)
b) Escrever a(s) configuração(ões) eletrônica(s) correspondente(s).
c) Escrever a reação deste cátion com hidróxido de sódio diluído.
d) Escrever a reação deste cátion com hidróxido de sódio concentrado.
e) Escrever a reação deste cátion com ácido sulfídrico
5. a) Qual é o cátion 4?
b) Dizer qual é a espécie que forma o cátion 4 , permitindo sua identificação na prova final.
c) Escreva a equação balanceada da reação de formação da solução verde
d) Escrever a equação balanceada da reação de formação do precipitado negro, a partir da solução verde.
e) Escrever a equação balanceada da reação entre o precipitado negro e o ácido clorídrico.
6. Dois dos quatro cátions são paramagnéticos, e dois são diamagnéticos. Identifique-os:
7. Espécie que forma o cátion 4 para sua identificação final:
8. Reação de formação da solução verde:
9. Reação de formação do precipitado negro, a partir da solução verde:
10. Reação entre o precipitado negro e o ácido clorídrico.
Problema 2
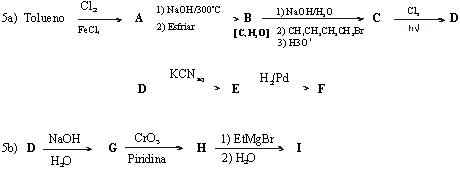
As transformações químicas entre grupos funcionais são a base da síntese orgânica e da determinação da estrutura química dos compostos orgânicos, em muitos casos. A seguir apresentamos um exemplo disso:
1a) O 1-bromobutano reage com hidróxido de potássio aquoso resultando no produto A.
1b) O composto A em presença de sódio metálico produz a substância intermediária B, observando-se desprendimento de um gás. Quando a substância intermediária B reage com brometo de etila resulta o composto C.
1c) Por outro lado, quando o 1-bromobutano reage com magnésio metálico em éter etílico anidro obtém-se o composto intermediário D que, adicionado ao valeraldeído (pentanal) resulta no intermediário E, que reage com ácido clorídrico diluído e produz o composto F.
1d) Se o composto F é aquecido na presença de ácido sulfúrico, forma o composto G.
1e) O composto G é submetido a uma reação de ozonólise seguida por tratamento com zinco metálico em meio ácido dando os produtos H e I.
1f) O composto G também reage com bromo em tetracloreto de carbono para dar o produto J, que após ser tratado com hidróxido de potássio e depois com sodamida a 150
1g) O composto L reage com o cloreto de metil-magnésio observando-se desprendimento de um gás para dar o intermediário M. A este, é adicionado 2-butanona e, em seguida, ácido clorídrico diluído obtendo-se o composto N.
Perguntas
1. Escreva as estruturas dos compostos
2. Escreva o nome químico dos produtos obtidos (exceto intermediários).
3. Quantos estereoisômeros tem o composto G ? Faça a representação estereoquímica e escreva o nome adequado de cada um.
4. Que gás se desprende na reação de A com sódio metálico? Escreva a fórmula e nome deste gás.
5. Que gás se desprende na reação de L com cloreto de metil-magnésio? Escreva a fórmula e o nome deste gás.
6. Quantos estereoisômeros se obtém ao tratar G com bromo em tetracloreto de carbono? Escreva os estereoisômeros formados usando a projeção de Fischer.
Problema 3
O cloreto de sódio é um dos compostos químicos de maior interesse devido, não só a sua importância em processos vitais como também pela grande quantidade de produtos industriais que são obtidos a partir dele. Este composto se encontra abundantemente na natureza acompanhado sempre de outros compostos químicos.
Para analisar uma amostra procedente de uma salina que continha unicamente uma mistura de NaCl e KCl, utilizaram-se três procedimentos diferentes, baseados todos na precipitação do cloreto em forma de AgCl.
I. Um método gravimétrico consiste em pesar o AgCl .
Este método consiste em precipitar os íons cloreto com um excesso de íons prata. O precipitado branco formado deve repousar. Este processo, chamado de digestão do precipitado, deve ser realizado em um lugar escuro. Passado certo tempo, o precipitado é separado por filtração, lavado e seco. Porém, se não forem tomadas precauções, este precipitado adquire um tonalidade acinzentada devido à decomposição causada pela luz, com produção de prata e cloro. Por sua vez, o cloro pode sofrer auto-redox, produzindo hipoclorito e cloretos quais são precipitados em excesso de íons prata. Estas reações de decomposição têm por conseqüência um erro na determinação.
II. A quantidade de íons prata necessária para obter um precipitado de AgCl pode também ser obtida pela oxidação de um eletrodo de prata.
III. Outro método alternativo, que permite determinar em um tempo menor a quantidade de cloretos presentes em uma amostra , se baseia na mesma reação de precipitação de AgCl. Neste método, a massa de precipitado não é pesada, mas mede-se a variação do potencial de um eletrodo de prata mergulhado na solução onde se realiza a precipitação (ou seja, acrescentando uma solução de íons Ag+ ou produzindo estes íons em forma culombimétrica).
Responda as perguntas apresentadas na folha de respostas, pois lhe permitirão comparar os três possíveis métodos.
I. Para efetuar a determinação por método gravimétrico, tomou-se uma massa de 0,1175 g da mistura de cloretos. Obteve-se uma massa de precipitado branco igual 0,2866 g .
I.1. A massa de NaCl presente nos 0,1175 g da mistura de cloretos , que deu lugar ao precipitado branco de massa igual a 0,2866 g, é: ____ g.
I.2. Isto corresponde a uma porcentagem de : ______ % NaCl
I.3. Escreva todas as equações das reações balanceadas que ocorrem quando o AgCl se decompõe por efeito da luz:
I.4. Os sólidos que são pesados em um precipitado de AgCl, parcialmente descomposto, são:
I.5. Se, durante o processo de digestão do precipitado, 10 % da massa total de AgCl forem decompostos pela luz, a massa de sólidos totais que são pesados em cada 100 g de AgCl (teórico) seria:
I.6. Isto significaria um erro de: por________________ de ___________%
excesso ou falta
II.1. A quantidade de eletricidade necessária para oxidar a prata e produzir 0,1434 g de AgCl é igual a: _____ C. * Faraday = 96500 C
II.2. Se esta oxidação é efetuada com uma intensidade constante e igual a 0,5 mA, o tempo necessário para precipitar 0.1434 g de AgCl será:
III. Ao responder as perguntas abaixo, você poderá concluir se o ponto final da reação corresponde a uma mudança significativa do valor do potencial. Considere para suas respostas que a quantidade da amostra pesada eqüivale a uma solução que contém uma concentração de íons cloreto igual a 0,10 mol/L.
III.1 Complete os quadros vazios da tabela abaixo, indicando a expressão que permite calcular o valor do potencial e o valor do referido potencial para as diferentes etapas da precipitação:
Etapa |
Expressão |
Valor de potencial/ENH |
Se há precipitação de 1% de Cl- |
||
Se há precipitação de 50% de Cl- |
||
Se há precipitação de 99 % de Cl- |
||
Se há precipitação de todo o Cl- e se há adição de excesso de íons Ag+ = 1% ( a respeito da concentração inicial de Cl- ) |
||
Se há precipitação de todo o Cl- e se há adição de excesso de íons Ag+ = 10% (a respeito da concentração inicial de Cl-) |
* Dados: Eo (V/ENH) Ag+ / Ago = 0.8 y AgCl/ Ago = 0,22
III.2 Desenhe a curva que representa o valor de " E versus volume de Ag+ adicionado"

III. Este método permite determinar o ponto de equivalência da reação de precipitação?
Sim
› Não ›IV. Escreva uma reação em que se utilize o NaCl como matéria prima na indústria:
Problema 4
Uma das melhores formas de obter alcanos é a reação de hidrogenação de alcenos. Este processo é útil para converter duplas ligações C=C em ligações simples. A hidrogenação é um processo exotérmico; de fato, as entalpias de hidrogenação (
D H) nos dão informação valiosa acerca da estabilidade relativa de compostos insaturados.1. No caso do 2 buteno, o isômero cis apresenta um
Comparando os valores de
D H de hidrogenação, pode-se concluir que o isômero mais estável é o: (Marque com uma cruz). Cis _____ Trans _____ .2.
Calcule o volume de hidrogênio, em litros, necessário para hidrogenar 110 g de trans-2-buteno, medido à pressão da Cidade do México de 0,77 atm e a temperatura de 25oC, considerando o comportamento geral dos gases:3. A medição do calor de combustão serve para determinar o calor de formação de muitos compostos orgânicos. Para a formação de CO2 (g) , o D Hf é - 393,51 kJ/mol . Para a formação de água líquida, o D Hf é de - 285,83 kJ/mol.
O D H de combustão do trans-2-buteno é de - 2707 kJ/mol. Com estes dados, calcule o D Hf do trans-2-buteno. Todos os dados são a 25oC
t / min |
0 |
5 |
10 |
15 |
20 |
25 |
ntrans-2-buteno/mol |
1,000 |
0,980 |
0,961 |
0,942 |
0,923 |
0,905 |
o processo ocorre num recipiente fechado, de volume constante de 100 litros e a temperatura constante de 25 ºC.
i) Calcule a constante de velocidade aparente da reação. Indique as unidades na sua resposta.
ii) Calcule o tempo em que será consumida a metade do trans-2-buteno.
iii) Depois de calcular a pressão inicial, calcule o tempo em que a pressão do sistema diminui a 2,5 atm.
5. Os catalisadores incrementam a velocidade de uma reação; porém, não modificam a situação final, apenas chega-se mais rapidamente ao equilíbrio.
A energia livre de Gibbs de formação a 25
° C do trans-2-buteno é 15,323 kcal/mol, a do cis-2-buteno 16,007 kcal/mol e a do butano -3,754 kcal/mol.i) Calcule a constante de equilíbrio para a reação de hidrogenação do trans-2-buteno, a uma temperatura constante de 25
ii) Para a reação de hidrogenação do trans-2-buteno, que efeito tem sobre a constante de equilíbrio um aumento de a temperatura?
Ao aumentar a temperatura, |
aumenta |
não muda |
diminui |
a constante de equilíbrio |
iii ) Que efeito tem sobre a constante de equilíbrio um aumento da pressão?
Ao aumentar a pressão, |
aumenta |
não muda |
diminui |
a constante de equilíbrio |
R = 0,08205 L . atm . mol-1 . K-1 R = 8,3140 J/mol . K
ii ) Para a reação de hidrogenação do trans-2-buteno, qual o efeito do aumento de temperatura sobre a constante de equilíbrio?
Ao aumentar a temperatura, |
aumenta |
não muda |
diminui |
a constante de equilíbrio |
iii ) Qual o efeito do aumento da pressão sobre a constante de equilíbrio ?
Ao aumentar a pressão, |
aumenta |
não muda |
diminui |
a constante de equilíbrio |
Problema 5
Em algumas das reações apresentadas abaixo, é possível obter mais de um isômero. Use, quando corresponder, o que se obtém em maior proporção. Responda somente o que se pergunta.
Perguntas.
1. Escreva as estruturas de A até J.
2. A reação do tolueno com cloro usando cloreto de ferro III é via radical livre ou iônica ?
3. A reação de C com cloro utilizando luz é via radical livre ou iônica ?
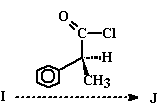
4. Se o produto I apresentar estereoisômeros, escreva suas estruturas e indique suas configurações absolutas (R ou S).
5. Qual é a configuração absoluta (R ou S) do reagente usado na reação de I a J?
6. Se o produto J obtido apresentar estereoisômeros, escreva suas estruturas e indique suas configurações absolutas (R ou S).
7. Mencione três constantes físicas que podem diferençar os estereoisômeros do composto J obtido.
Problema 6
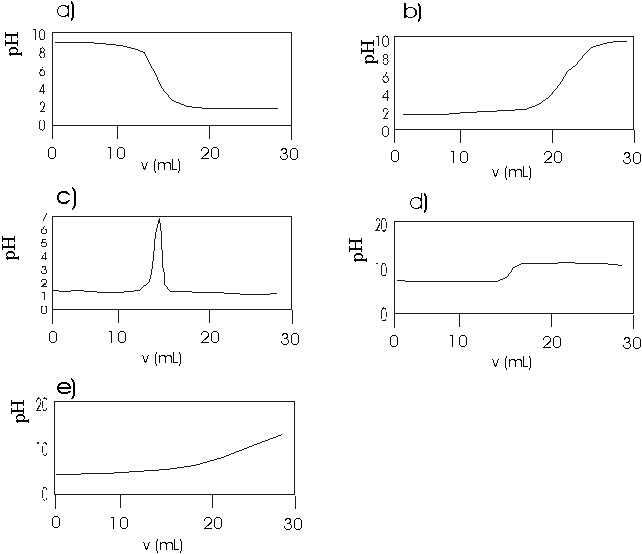
INVESTIGAÇÃO DE UM PRECIPITADO.
Muitos cátions metálicos precipitam na forma de hidróxidos quando são tratados com uma solução de hidróxido de sódio ou potássio; com freqüência, esta propriedade se utiliza para a identificação de alguns destes cátions.
Porém, estas reações não são tão simples como à primeira vista pode parecer. Assim é o caso da reação do sulfato de cobre (II) com hidróxido de sódio, que pode ser feita de duas maneiras diferentes.
Se a solução do sulfato de cobre (II) é vertida sobre a base alcalina em excesso, obtém-se um precipitado de hidróxido de cobre (II) de cor azul. Porém, quando o hidróxido alcalino é vertido lentamente sobre a solução de sulfato, observa-se a formação de um precipitado de cor verde claro. A fórmula deste precipitado não está claramente definida e varia de acordo com diferentes autores. De forma geral, esta reação pode ser escrita como:
x Cu
2+ + y OH- + z SO42+ ® (Cu2+)x ( OH- )y ( SO42-)z ¯Você pode determinar os valores dos coeficientes estequiométricos (x,y,z) a partir dos resultados de um procedimento experimental que foi realizado com esta finalidade e que é descrito a seguir:
a) Tomaram-se 10 mL de uma solução 0,2 mol/L de sulfato de cobre (II), à qual se adicionaram volumes medidos de uma solução de NaOH 0,200 mol/L. Depois de cada adição, mediu-se o pH da solução. Desde as primeiras adições, observou-se a formação de um precipitado, P, de cor verde claro e verificou-se que o ponto final da reação coincidiu com um volume de 14,95 mL da solução de NaOH.
b) Uma vez atingido este ponto final, após a filtração, o precipitado P foi lavado cuidadosamente com água (a solução filtrada F era incolor). O precipitado P foi redissolvido em HCl diluído e esta solução foi completada até um volume de 50.0 mL ( solução R) .
c) Da solução R tomou-se uma alíquota de 25,0 mL, a qual foi tratada com um excesso de KI. O iodo liberado foi titulado com uma solução de Na
2S2O3 0,100 mol/L usando amido como indicador. Foram necessários 9,90 mL da solução de tiossulfato para atingir o ponto final (viragem) da titulação.d) Outra alíquota de 25.0 mL da solução R foi tratada com cloreto de bário em excesso e foi aquecida para permitir a coagulação do precipitado branco formado. A massa pesada deste precipitado obtido (precipitado T), uma vez lavado e seco, foi de 0,1167 g .
Responda:
1. Qual é a equação da reação realizada na etapa b do procedimento anterior?
2. Quais são as equações da reação realizada na etapa c do procedimento anterior?
3. A quantidade de cobre inicial utilizada na experiência é: ___ mol.
4. O número de mols de NaOH adicionados para alcançar o ponto final é: ___.
5. Que substância(s) contém a solução filtrada F ?
6. Indique uma reação que permita, com um experimento simples, verificar a presença ou a ausência de íons Cu
2+ na solução do filtrado F . Indique o que seria observado.7. O número de mols de tiossulfato usados na titulação da alíquota é: ___ mol.
8. A quantidade total de Cu (II) no precipitado P é: ___ mol.
9. A fórmula do composto que constitui o precipitado branco T obtido é:
10. A quantidade que corresponde aos 0,1167 g do precipitado branco T obtido é : ___ mol.
11. De acordo com suas respostas anteriores, a fórmula mínima do precipitado verde formado (P) é:
12. A expressão do produto de solubilidade do precipitado é:
13. O gráfico que representa a variação do pH durante a adição de NaOH à solução de CuSO4 é: