espécies
![]() /cal.mol-1.K-1
a 298,15 K
/cal.mol-1.K-1
a 298,15 K
![]() /kcal.mol-1
/kcal.mol-1
HCl(g)
-37,72
-22,019
O2(g)
-42,06
0
Cl2(g)
-45,93
0
H2O(g)
-37,17
-57,107
As teorias são construções nascidas da especulação e/ou experimentação que procuram explicar ou predizer os fatos experimentais. Associados às teorias existem os modelos. A finalidade dos modelos é principalmente didática. Por isso, embora as teorias sejam constantemente ultrapassadas por teorias mais modernas e com maior poder explicativo, os modelos de maior potencial didático sobrevivem na sua faixa de ação.
Embora a teoria de Bohr tenha sido rapidamente ultrapassada pelas novas teorias quânticas, a simplicidade matemática de seu modelo e seu potencial didático em explicar qualitativamente os espectros atômicos tornam obrigatório o seu estudo.
O modelo de Bohr é de fácil dedução a partir de seus postulados. Supõe a existência de órbitas circulares por onde giram os elétrons sem alterarem sua energia (órbitas estacionárias). A distância destas órbitas ao núcleo e suas energias dependem do número quântico n. Quando um elétron muda de órbita ganha ou perde energia. A perda de energia pode se dar na forma de radiação eletromagnética de comprimento de onda ( ) bem definido.
Relacionado ao modelo de Bohr responda:
1.1. Em que se fundamenta (sob a ótica do modelo de Bohr) o teste da chama ?
1.2. Como este modelo pode ser usado para explicar os espectros atômicos?
1.3. Por que o modelo de Bohr só funcionou bem para o átomo de hidrogênio?
1.4. Como é possível descobrir os constituintes químicos de uma estrela distante pela análise da luz emitida?
2.1. Os dois átomos de hidrogênio do carbono a da Gly são considerados pró-quirais, pois, quando um deles é substituído por outro grupo, o carbono a se torna quiral. Desenhe uma projeção de Fischer da Gly e indique qual hidrogênio deve ser substituído por CH3 para que se obtenha a D-Ala.
2.2. O tratamento de um polipeptídeo com 2-mercaptoetanol produz dois polipeptídeos:
Ala-Val-Cys-Arg-Thr-Gly-Cys-Lys-Asn-Phe-Leu
Tyr-Lys-Cys-Phe-Arg-His-Thr-Lys-Cys-Ser
Indique as posições das pontes de dissulfeto no polipeptídeo original.
Os dados da tabela abaixo, foram obtidos a 25°C para a reação:
4HCl(g) + O2(g) < -----> 2Cl2(g) + 2H2O(g)
|
espécies
|
|
|
|
HCl(g) |
-37,72 |
-22,019 |
|
O2(g) |
-42,06 |
0 |
|
Cl2(g) |
-45,93 |
0 |
|
H2O(g) |
-37,17 |
-57,107 |
3.1. Calcule a constante de equilíbrio;
3.2. Escreva a expressão para a constante de equilíbrio, Kp, utilizando a função-energia livre de Gibbs;
3.3. Transforme a constante relativa à pressões em valores relativos à concentração e frações molares.
3.4.
Qual o significado de delta
![]() ?
?
3.5. Assinale a opção que corresponde ao efeito do aumento da pressão do sistema sobre a concentração de Cl2 no equilíbrio.
( A ) aumenta
( B ) diminui
( C ) não altera
Os
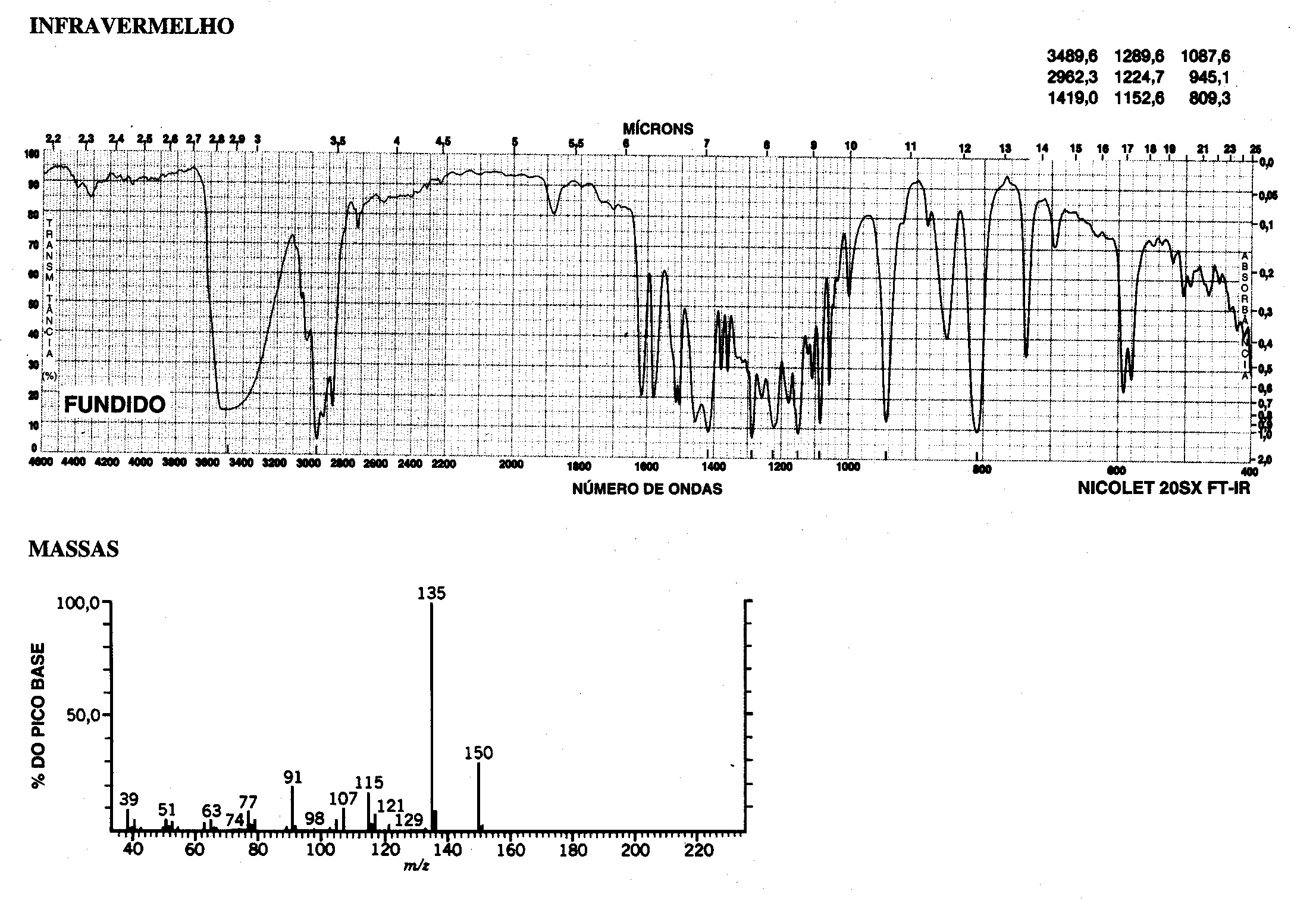
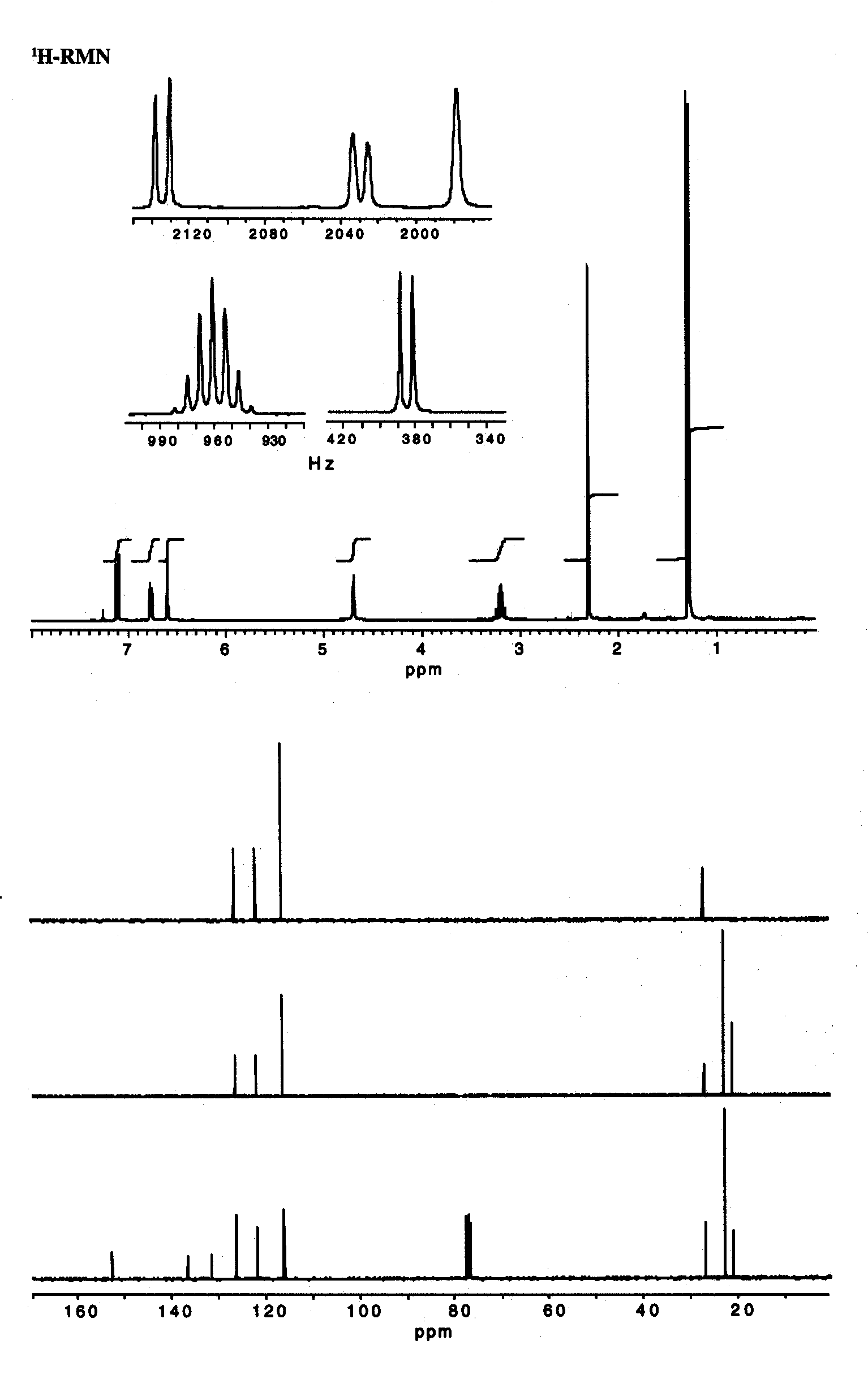
espectros de infravermelho, massas, ressonância magnética nuclear de hidrogênio
e carbono-13 fornecidos, são de um composto natural, com forte ação
antimicrobiana encontrado em óleos essenciais de alecrim. O espectro de UV
apresenta absorções fracas acima de 200 nm.
4.1. Qual grupo funcional é responsável pela absorção forte acima de 3000 cm-1 no espectro de infravermelho?
4.2. O hepteto em d 3,20 e o dubleto em d 1,28 são indicativos da presença de quais grupos?
4.3. Qual a fórmula molecular do composto?
4.4. Qual o equivalente de insaturação do composto?
4.5. A análise dos espectros fornecidos permite verificar que existe mais de uma possibilidade estrutural para o composto. Desenhe suas estruturas.
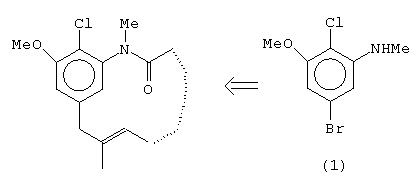
Um grupo de compostos com atividade antileucêmica, apresenta um anel aromático como parte de sua estrutura complexa. A síntese destas moléculas pode ser realizada a partir de um anel aromático com quatro substituintes diferentes:
A preparação do composto aromático tetrassubstituído (1) ocorre de acordo com a seqüência de reações mostrada a seguir:
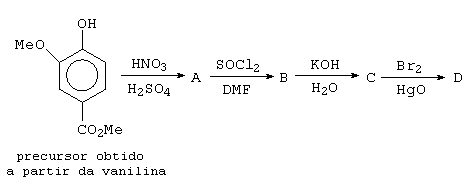
·
Escreva as estruturas dos
compostos representados pelas letras A, B,
C, D,
E, e F
NOTA: Observe que nesta seqüência, há duas substituições eletrofílicas aromáticas, dentre as quais, uma não usual. Há também, dentre as demais reações, uma reação de substituição nucleofílica aromática.
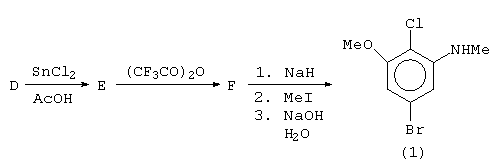
O
álcool etílico líquido tem calor de vaporização igual a 39,3 kJ/mol e as
energias das ligações: C-C, C-O, O-H e O-O, em kJ/mol, são, respectivamente:
348; 356; 463 e 493.
6.1. Elabore um esquema (ciclo de Born-Haber) para indicar a obtenção de álcool etílico a partir de seus constituintes.
6.2. Estes dados são suficientes para se calcular o DHfo do álcool etílico? Justifique